Баллонная ангиопластика транслюминальная (ТЛБАП) и стентирование коронарных артерий или чрескожное коронарное вмешательство (ЧКВ)
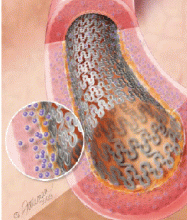
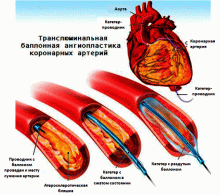

Хирургические методы лечения ИБС имеют своей целью прямое увеличение коронарного кровотока – реваскуляризацию миокарда.
Транслюминальная баллонная ангиопластика (ТЛБАП) – операция, позволяющая восстановить кровоток в артериях сердца (коронарных артериях) путём проведения катетера с баллоном и последующем его раздуванием. Операция ТЛБАП сопровождалась высоким риском осложнений в виде повторного сужения сосуда – рестеноза, острых окклюзий. В современной эндоваскулярной хирургии ТЛБАП выполняется вместе с эндопротезированием венечных (коронарных) артерий, т.е. имплантацией стентов в коронарное русло.
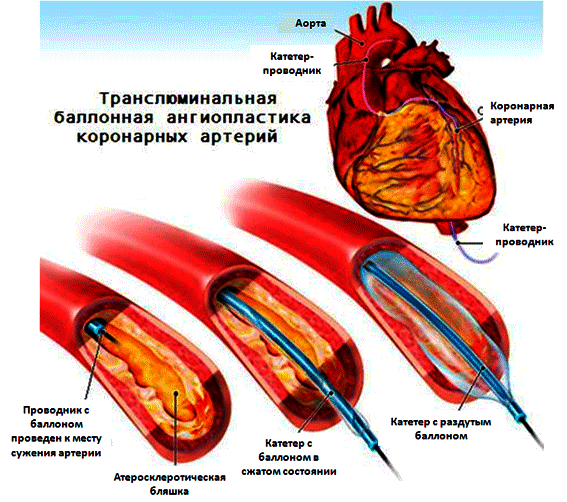
Положительные результаты рандомизированных исследований сделало стентирования коронарных артерий ведущим стандартом в лечении больных ИБС. С 1999 году под термином чрескожное коронарное вмешательство «по умолчанию» подразумевать именно стентирование коронарных артерий.
Стентирование коронарных артерий или чрескожное коронарное вмешательство – операция, позволяющая восстановить кровоток в артериях сердца (коронарных артериях) путём имплантации стентов в месте сужения коронарной артерии.
Сегодня коронарное стентирование занимает ведущее место в эндоваскулярном лечении больных ИБС. Внедрение этого метода позволило значительно улучшить результаты традиционной ТЛБАП – как непосредственные, так и отдаленные. Основным недостатком стентирования (как и баллонной ангиопластики) является относительно высокая частота рестенозирования. Если применение эндопротезов кардинально решило проблему таких острых осложнений ТЛБАП, как диссекции и острые окклюзии, сведя к минимуму летальность и прочие ишемические осложнения (соответственно, и необходимость выполнения экстренной АКШ), а применение нового режима вспомогательной фармакотерапии (аспирин, клопидогрель, ингибиторы IIb/IIIa-рецепторов), с одной стороны, практически свело к нулю частоту развития подострого тромбоза стентов (и связанных с этим ишемических осложнений), а с другой – позволило имплантировать эндопротезы при остром коронарном синдроме, то в плане отдаленных результатов не произошло революционного сдвига.
Несмотря на то, что отдаленные результаты после стентирования и превосходят результаты ТЛБАП (частота рестенозирования в различных клинических ситуациях в среднем в 1,5–2,5 раза ниже, чем после баллонной дилатации), все же самым серьезным недостатком эндопротезирования (как и всех эндоваскулярных методик) остается относительно высокая частота возврата стенокардии в отдаленном периоде и, соответственно, частая необходимость повторной реваскуляризации миокарда.
Стент – внутрисосудистый протез для поддержания стенки пораженного сосуда и сохранения диаметра его просвета. Конструкция стента представляет собой тонкий сетчатый каркас из инертного металлического сплава высочайшего качества, раскрываемый баллоном внутри сосуда до нужного диаметра.
Виды стентов:
Металлический стент (Bare Metal Stent) – внутрисосудистый протез из нержавеющей стали или кобальт-хромового сплава. Использование металлических стентов связано с риском тромбоза в первые 30 дней и требует двойной антитромбоцитарной терапии в течении 1 месяца, а также 20-30% риском рестеноза (повторного сужения сосуда) в течение 6-9 месяцев после имплантации.

Стент с лекарственным покрытием — внутрисосудистый протез с покрытием (полимером), высвобождающим лекарственное вещество.
Стент с лекарственным антипролиферативным покрытием — внутрисосудистый протез из кобальт-хромового сплава с покрытием, высвобождающее лекарственное вещество, препятствующее повторному сужению сосуда. Лекарственный слой в последствии растворяется.
Первое поколение стентов с лекарственным покрытием: сиролимус- и паклитаксел-покрытые стенты. Множественные рандомизированные исследования показали, что сиролимус- и паклитаксел-покрытые стенты ассоциируются со снижением частоты повторной реваскуляризации и смерти от инфаркта миокарда по сравнению с металлическими стентами. В состав покрытия стентов первого поколения входили полимеры, которые облегчали высвобождение лекарственных компонентов, но оставались на стенте после растворения медикаментозного слоя. Эти постоянные полимеры могут вызывать воспаление и задержку эндотелизации, что требует длительной двойной антиагрегантной терапии с целью предупреждения высокого уровня поздних и очень поздних тромбозов стентов.
За последнее время использование стентов с лекарственным покрытием показало явное их преимущество в борьбе с рестенозом. В клинической практике при использовании стентов без покрытия частота рестеноза в отдаленном периоде оставалась на относительно высоком уровне, начали рассматривать полимерные покрытия как транспортное средство для местной доставки препарата. Целью этого является дозированное выделение необходимого лекарственного средства из устойчивого покрытия в локальную зону поражения сосудистой стенки. Выделение препарата происходит в равномерно дозированной концентрации в определенном временном интервале. Система доставки препарата не теряет своих свойств при стерилизации, так же изменяет свою геометрическую и объемную форму вслед за стентом при его имплантации и устойчива к механическим повреждениям вследствие раздувания баллона. Все вышеизложенные свойства системы локальной доставки препарата осуществляются с помощью разнообразных полимерных структур, обеспечивающих целостность данной структуры при клиническом применении.
Лекарственный препарат должен обладать способностью ингибировать наибольшее количество различных компонентов комплексного процесса рестенозирования. Безудержный рост неоинтимы по некоторым основным характеристикам схож с ростом опухоли, что навело на мысль использования цитостатических препаратов Rapamycin (Sirolimus) и Paclitaxel (Taxol). Результаты превзошли все ожидания.
Второе поколение стентов с лекарственным покрытием: зотаролимус- и эверолимус- покрытые стенты. Стенты изготовлены из более тонкого кобальт-хромового сплава (балки стента — 0,091 мм, по сравнению со стентами первого поколения, где этот показатель составлял – 0,132 мм), демонстрируют превосходную прочность и радиоконтрастность, гибкость что способствует снижению частоты рестеноза. Лекарственный компонент покрытия из более биосовместимых полимеров наносится на всю поверхность стента, примерно 95% от общего количества зотаролимуса высвобождается в течение первых 15 дней после установки стента, эверолимуса – 80% в течение 30дней, последующие 20% за 4 месяца, что позволяет уменьшить воспаление сосудистой стенки. Клинические результаты в сравнении со стентами первого поколения показали эффективность и безопасность.
Стенты третьего поколения – бесполимерные биостенты на основе поли-L лактида или магния созданы с использованием частично и даже полностью биорастворимых полимеров. Биорассасывающиеся магниево-полимерные стенты полностью исчезают после того, как необходимая доза лекарственного компонента высвободилась и лечение сосуда завершено. Высвобождение лекарственных веществ и поддержание стенки сосуда осуществляется только до тех пор, пока сосуду необходимо лечение. Стенты с покрытием, подвергающимся полному биорассасыванию снижают частоту тромбоза стентов по сравнению со стентами без и с лекарственным покрытием.
Возможные перспективы рентгеноэндоваскулярной хирургии ИБС – широкое внедрение в клиническую практику новых генераций стентов с новыми биоабсорбируемыми полимерными покрытиями. Тем не менее их начальному применению должны предшествовать длительные и всеобъемлющие исследования по изучению непосредственных, особенно отдаленных, результатов после их использования.
Таким образом, на сегодняшний день нет альтернативы применению стентов с лекарственным антипролиферативным покрытием в лечении пациентов с ИБС. Широко дискутируемые данные о возможных поздних осложнениях (поздний тромбоз) ни в коей мере не могут являться основанием к прекращению их использования, а лишь дополнительно подчеркивают важность правильного определения показаний к стентированию, тщательного соблюдения всех технических аспектов процедуры имплантации, досконального соблюдения режима двухкомпонентной дезагрегантной терапии в отдаленном периоде.
Непрерывное улучшение конструкции стентов, приводящее к внедрению новых технических методик имплантации, таких как использование высокого давления, методика прямого стентирования (возможного благодаря уменьшению профиля стентов и закреплению его на баллонный катетер доставляющей системы); внедрение таких дополнительных методов визуализации, как интракоронарное ультразвуковое исследование (позволяющих оптимизировать окончательный результат эндопротезирования с высокой степенью точности); тщательный отбор пациентов для проведения процедуры (в зависимости от прогнозируемых непосредственных и отдаленных результатов), основанный на накопленном к настоящему времени колоссальном опыте, – все это позволяет надеяться на улучшение результатов как непосредственно данного метода, так и в целом результатов лечения больных ИБС.
Таким образом, высока вероятность того, что уже в ближайшем будущем изменятся как результаты эндоваскулярного лечения больных ИБС, так и концепция выбора метода реваскуляризации миокарда, подходы к лечению этого заболевания в целом. Применение стентов с лекарственным антипролиферативным покрытием является высокоэффективным методом лечения пациентов с различными клиническими формами ИБС и разными морфологически неблагоприятными вариантами поражения коронарного русла. Применение стентов с антипролиферативным покрытием, несмотря на увеличение объема и комплексности выполняемых вмешательств, позволяет добиться значительного снижения частоты рестенозирования в отдаленном периоде наблюдения – основного фактора, ограничивающего эффективность рентгеноэндоваскулярного лечения.