Диагностика и лечение обмороков. Рекомендации Европейской ассоциации ритма сердца. Диагностика







Первичная оценка, диагностика и стратификация риска
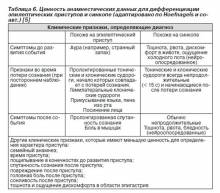
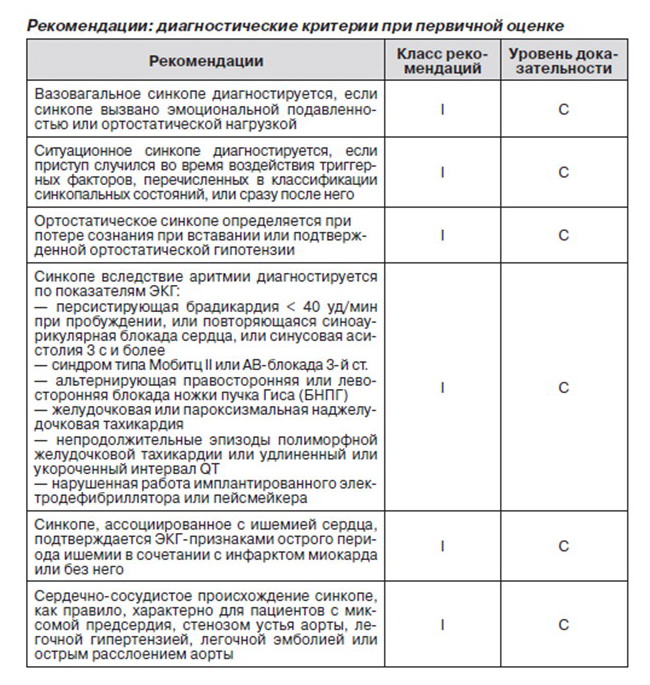
2.1. Первичная оценка. Первичное обследование пациента, перенесшего кратковременную потерю сознания, включает тщательный сбор анамнеза, объективное обследование, в том числе измерение артериального давления в положении стоя, электрокардиографию. Только с учетом этих данных можно проводить дальнейшее обследование:
— массаж каротидного синуса у пациентов младше 40 лет;
— эхокардиографию в случае подтвержденного заболевания сердца, при подозрении на него или синкопе вследствие сердечно-сосудистой патологии;
— ЭКГ-мониторирование при подозрении на синкопе аритмического происхождения;
— ортостатические пробы (активная (переход из положения лежа в положение стоя) и пассивная) в случае, если синкопе ассоциируется с пребыванием в положении стоя или при подозрении на рефлекторный механизм.
Другие обследования, такие как неврологическое, анализ крови, показаны при подозрении на несинкопальную природу потери сознания.
Исходные обследования должны ответить на 3 основных вопроса:
1. Синкопальный ли это эпизод?
2. Выявлена ли причина такого состояния?
3. Являются ли полученные данные основанием предполагать высокий риск сердечно-сосудистых заболеваний или смерти?
2.1.1. Диагностика синкопе
Как правило, дифференцировать синкопальное состояние от потери сознания несинкопальной природы может помочь тщательно собранный анамнез [66–68], но порой сделать это достаточно сложно. Необходимо выяснить несколько вопросов:
1. Была ли потеря сознания полной?
2. Была ли потеря сознания транзиторной с быстрым развитием приступа или непродолжительной?
3. Отмечалось ли у пациента разрешение состояния спонтанное, полное, с последствиями?
4. Терял ли пациент постуральный тонус?
Если ответы на поставленные вопросы положительные, то, вероятнее всего, мы имеем дело с синкопе. Если же хотя бы на один вопрос ответ отрицательный, то перед тем как продолжить оценку синкопе, следует исключить другие формы потери сознания.
2.1.2. Этиологический диагноз
У 25–50 % пациентов при первичном обследовании состояния возможно выявить причину синкопе [33, 69]. Существует ряд важных моментов, которые необходимо отобразить в истории болезни. Для постановки диагноза, определения объема дальнейших исследований и назначения лечения должны быть учтены данные анамнеза, объективного обследования, ЭКГ.
В противном случае невозможно поставить правильный диагноз, а значит, можно лишь предполагать причины синкопе. В связи с этим необходимо проведение дополнительных исследований.
2.1.3. Стратификация риска
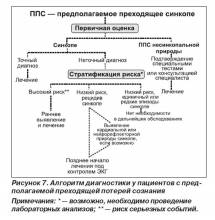
В случае если остается невыясненной этиология синкопе при первом обследовании, следующим шагом должна стать оценка риска развития наиболее вероятных сердечно-сосудистых событий или внезапной кардиальной смерти. На рис. 7 представлен алгоритм обследования данной категории пациентов.

В последней редакции руководства по предупреждению внезапной кардиальной смерти и кардиостимуляции выделены основные признаки высокого риска сердечно-сосудистых событий или ВСС (см. стратификацию риска) [70–73].
2.2. Диагностические исследования
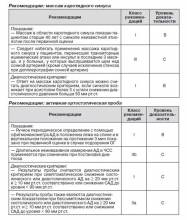
2.2.1. Массаж каротидного синуса
Давно установлено, что давление в области бифуркации каротидной артерии замедляет прогрессирование сердечной недостаточности и способствует снижению артериального давления. У некоторых лиц эффект, вызываемый МКС, может вызвать необычную реакцию. Эпизод асистолии желудочков, длившийся 3 с, и/или снижение систолического давления менее 50 мм рт.ст. являются признаками гиперчувствительности каротидного синуса (ГЧКС). При спонтанном синкопе ГЧКС может стать причиной ВСС. В предыдущей редакции руководства по ведению синкопе детально описана методика МКС и его последствия [1]. Для установления диагноза СКС необходимо воспроизведение спонтанных симптомов в течение 10 с после правостороннего и левостороннего МКС в положении лежа на спине и в вертикальном при постоянном мониторинге частоты сердечного ритма и периодического измерения АД, что позволит лучше оценить вазодепрессорный компонент [74]. Необходимо подчеркнуть, что ГЧКС чаще встречается у пожилых лиц мужского пола [8]. В то же время СКС — явление достаточно редкое у лиц старше 40 лет [74].
Связь между патологическим ответом на МКС и синкопе является очень важным моментом, который следует изучить. С этой целью применяются 2 метода. Во-первых, необходимо сравнить частоту синкопальных эпизодов до и после кардиостимуляции. В нерандомизированных исследованиях было продемонстрировано, что в период наблюдения у пациентов с имплантированным кардиостимулятором отмечалась меньшая частота рецидивов по сравнению с пациентами без клинических признаков при первичной оценке эффекта кардиостимуляции [76, 77].
Второй метод заключается в анализе частоты эпизодов асистолии у пациентов с кардиоингибиторным вариантом ответа на массаж в области каротидного синуса имплантированным прибором. В двух исследованиях, в которых применялась данная методика, длинные паузы регистрировались приблизительно с одинаковой частотой [78, 79]. Полученные результаты дают основания полагать, что позитивный ответ на массаж в области каротидного синуса является достоверным предиктором развития спонтанной асистолии.
Клинические особенности, указывающие на диагноз при первичном осмотре:
Нейроопосредованные синкопе:
— отсутствие патологии сердца;
— длительный анамнез повторных синкопе;
— развитие синкопе после неожиданного неприятного звука, запаха, образа или боли;
— длительное стояние или пребывание в людных, душных местах;
— тошнота, рвота, ассоциированные с синкопе;
— развитие синкопе во время или после приема пищи;
— развитие синкопе при вращениях головой длительное время или при сдавлении каротидного синуса (при опухолях в данной области, во время бритья, при ношении тугих воротников);
— после нервного напряжения.
Синкопе, ассоциированные с ортостатической гипотензией:
— развитие синкопе после длительного пребывания в положении стоя;
— временная взаимосвязь с началом приема сосудосуживающих препаратов или изменением их дозы, что могло бы привести к гипотензии;
— длительное пребывание в положении стоя, особенно в людных и душных местах;
— наличие автономной невропатии или болезни Паркинсона;
— стояние после нервного напряжения.
Синкопе кардиоваскулярной природы:
— наличие органической патологии сердца;
— наличие в семейном анамнезе внезапной смерти или патологии ионных каналов;
— отклонения на ЭКГ;
— неожиданный приступ учащенного сердцебиения, после которого сразу развился приступ синкопе;
— ЭКГ-признаки синкопе вследствие аритмии:
— двухпучковая блокада (определенная как блокада левой или правой ножки пучка Гиса в сочетании с блокадой передневерхнего или нижнезаднего разветвления левой ножки пучка Гиса);
— другие отклонения внутрижелудочковой проводимости (длительность QRS ≥ 0,12 с);
— АВ-блокада второй степени типа Мобитц I;
— бессимптомная синусовая брадикардия (< 50 уд/мин), синоаурикулярная блокада или синусовая пауза ≥ 3 с при отсутствии препаратов с отрицательным хронотропным эффектом;
— непродолжительная желудочковая тахикардия;
— стимулированные QRS-комплексы;
— длинные или короткие интервалы QT;
— ранняя реполяризация;
— паттерн блокады правой ножки пучка Гиса с подъемом сегмента ST в отведениях V1–V3 (синдром Бругада);
— подозрение на аритмогенную кардиопатию правого желудочка в связи с наличием отрицательных Т-волн в правом грудном отведении, эпсилон-волн и поздних желудочковых потенциалов;
— характер Q-волн свидетельствует об инфаркте миокарда.
Основные осложнения массажа каротидного синуса — неврологического характера. При анализе данных трех исследований [74, 80, 81], в которых были обследованы 7319 пациентов, осложнения неврологического характера были зарегистрированы у 21 (0,29 %). Следует избегать проведения массажа каротидного синуса у пациентов с транзиторными ишемическими атаками, перенесших инсульт в последние 3 месяца, у пациентов, у которых выслушивается шум над сонной артерией, кроме случаев исключения стеноза при допплерографии сонной артерии [80].
Стратификация риска. Факторы высокого риска, наличие которых требует немедленной госпитализации или оказания интенсивной помощи
Тяжелое органическое заболевание сердца или ишемическая болезнь сердца (сердечная недостаточность, сниженная фракция выброса левого желудочка или инфаркт миокарда в анамнезе)
Клинические или ЭКГ-признаки синкопе аритмогенной этиологии:
— приступ синкопе во время напряжения или в положении лежа на спине;
— учащение сердцебиения во время синкопе;
— случаи внезапной смерти в семейном анамнезе;
— непродолжительная желудочковая тахикардия;
— двухпучковая блокада (блокада левой или правой ножки пучка Гиса в сочетании с блокадой передневерхнего или нижнезаднего разветвления левой ножки пучка Гиса) или другие отклонения внутрижелудочковой проводимости с длительностью QRS ≥ 120 мс);
— бессимптомная синусовая брадикардия (< 50 уд/мин), синоаурикулярная блокада или синусовая пауза ≥ 3 с при отсутствии препаратов с отрицательным хронотропным эффектом или физического напряжения;
— стимулированные QRS-комплексы;
— длинные или короткие интервалы QT;
— паттерн блокады правой ножки пучка Гиса с подъемом сегмента ST в отведениях V1–V3 (синдром Бругада);
— подозрение на аритмогенную кардиопатию правого желудочка в связи с наличием отрицательных Т-волн в правом грудном отведении, эпсилон-волн и поздних желудочковых потенциалов.
Важные сопутствующие патологические состояния:
— анемия тяжелой степени;
— нарушение электролитного баланса.
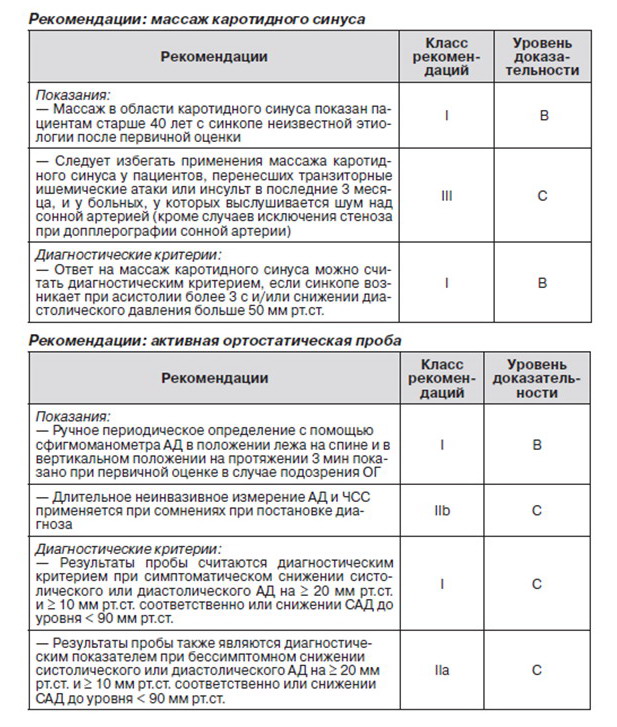
2.2.2. Ортостатическая проба
Изменение положения тела из положения лежа на спине в вертикальное обусловливает перемещение крови из грудной области в нижние конечности, что, в свою очередь, приводит к уменьшению венозного оттока и содержания СО. При неадекватности компенсаторных механизмов резкое снижение АД может привести к синкопе [82].
На сегодня существует два метода оценки ответа на изменения положения при переходе в положение стоя из положения лежа на спине (табл. 1) [11].
Один из них — это активная ортостатическая проба, при которой пациент резко встает из положения лежа на спине. Второй метод — пассивная ортостатическая проба (head up tilt) с углом наклона от 60° до 70°.
2.2.2.1. Активное стояние
Данный тест проводится с целью выявления так называемой ортостатической непереносимости (см. 1.2.2.2, табл. 1).
Для рутинного клинического обследования, как правило, используется сфигмоманометр ввиду его доступности и простоты применения. Применение приборов с автоматической накачкой манжет, которые запрограммированы для повторного измерения в случае противоречивых показателей, неэффективно в связи с резким снижением АД при ортостатической гипотензии. С помощью сфигмоманометра можно провести лишь четыре измерения в минуту на одной руке без развития стеноза вен в ней. При необходимости проведения более частых измерений возможно дальнейшее неинвазивное определение АД и ЧСС.
2.2.2.2. Тилт-тест (пассивная ортостатическая проба)
Основания
Тилт-тест позволяет воспроизвести нейроопосредованный рефлекс в лабораторных условиях. Скопление крови и уменьшение венозного оттока вследствие ортостатической нагрузки и неподвижности вызывают данный рефлекс. В результате гипотензия и обычно сопутствующее ей снижение ЧСС ассоциируются с поврежденной сосудосуживающей способностью вследствие торможения симпатических импульсов и гиперактивности вагуса.

Тилт-тесту соответствует клиническая ситуация, когда развивается рефлекторное синкопе в связи с длительным пребыванием в положении стоя. Однако данный тест может быть положительным также у пациентов с другими формами рефлекторного синкопе [83] и с синдромом слабости синусового узла [84].
Методика
Тилт-тест был внедрен в клиническую практику для оценки состояния пациентов с синкопе неизвестной этиологии Kenny и соавт. в 1986 г. С тех пор было разработано немало протоколов проведения данного теста, в которых оговаривались изначальные параметры обеспечения устойчивости, длительность, тилт-угол, способ поддержки, фармакологические провокации. Во многих обзорах детально описаны чувствительность и специфичность методик проведения теста [1, 86]. Наиболее часто используется методика нагрузки низкой дозой изопротеренола, введенного внутривенно; при этом дозу постепенно повышают с целью увеличения средней ЧСС приблизительно на 20–25 % от исходного уровня [87]. Также часто применяют методику нагрузки нитроглицерином под язык после 20-ми-нутной паузы приема препарата. У пациентов пожилого возраста начало теста сразу с нагрузки нитроглицерином без предшествующей пассивной фазы (без лекарства) может быть эффективным и улучшить комплайенс [89]. Обе методики отличаются достаточно высокой частотой позитивного ответа (61–69 %) и высокой специфичностью (92–94 %). Нельзя принимать пищу за 4 ч до проведения теста. В связи с необходимостью катетеризации вены подготовительная фаза при применении изопротеренола составляет 20 мин, тогда как при нитроглицерине — только 5 мин.
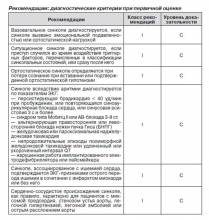
Показания. Во многих исследованиях отмечается, что проведение пассивной ортостатической пробы показано у пациентов с неподтвержденным при первичной оценке диагнозом рефлекторного синкопе [85–89].
Нет необходимости в тилт-тесте у пациентов, у которых диагноз рефлекторного синкопе выставлен согласно данным истории болезни, или у больных с единичными или редкими приступами синкопе, кроме отдельных случаев (повреждения, тревожность, профессиональные занятия, например, летчик и т.д.). Известно, что пассивная ортостатическая проба может быть информативной у пациентов с высоким риском сердечно-сосудистых событий или с синкопе аритмического генеза, однако должна быть исключена кардиоваскулярная причина при тщательном исследовании. У пациентов с преходящей потерей сознания, ассоциированной с судорогами, ортостатическая проба поможет распознать синкопе эпилептического генеза [90]. Данный тест также используется у пациентов с частыми эпизодами преходящей потери сознания и подозрением на психиатрические проблемы, при травме для выявления рефлекторной природы синкопе [91]. Кроме того, ортостатическая проба применяется у больных пожилого возраста с целью разграничить синкопальное состояние и другую патологию, сопровождающуюся потерей сознания [92].
Тилт-тест используется для разграничения чистого рефлекторного синкопе и неклассических форм поздней/отсроченной ортостатической гипотензии (табл. 1) [14]. Однако его результаты не показательны относительно эффективности лечения [93]. Тилт-тест признан ASA информативным для выявления склонности пациента к рефлекторному синкопе, а значит, на основании его результатов возможно назначать лечение [94–96].
Ответ на тилт-тест. Результаты тилт-теста могут указывать либо на рефлекторную гипотензию/брадикардию, либо на позднюю ОГ, ассоциированную с синкопальными или пресинкопальными состояниями. Характер ответа на вызванный рефлекс определяют в зависимости от доминирующего компонента — вазодепрессорного или кардиоингибиторного (соответственно кардиоингибиторный, вазодепрессорный ответ или смешанного типа) [97]. При этом отрицательный результат тилт-теста не является основанием для исключения диагноза рефлекторного синкопе.
Сегодня поставлена под сомнение клиническая достоверность ответа на тилт-тест как фактора, определяющего состояние АД и ЧСС во время синкопе [98, 99]. В некоторых исследованиях сравнивали ответ на тилт-тест с данными о состоянии во время спонтанного синкопе, полученными с помощью имплантированного петлевого регистратора. Позитивный кардиоингибиторный ответ на тилт-тест свидетельствует о высокой вероятности развития спонтанного синкопе асистолического генеза. Наличие же позитивного вазодепрессорного или смешанного ответа не исключает возможность асистолии во время спонтанного синкопе [98, 99].
Осложнения и противопоказания. Тилт-тест является безопасным методом диагностики. Неизвестно ни об одном случае смерти во время его проведения. Однако существуют данные о возможности развития жизнеугрожающих желудочковых аритмий, вызванных введением изопротеренола при наличии у пациента ИБС [100] или синдрома слабости синусового узла [101]. Нет сведений и об осложнениях при проведении теста с использованием нитроглицерина. Возможны незначительно выраженные побочные эффекты при проведении данного теста, в частности учащение сердцебиения при приеме изопротеренола или головная боль при приеме нитроглицерина. Несмотря на низкий риск осложнений и побочных явлений, все-таки рекомендуют подготовить реанимационную аппаратуру.
Противопоказаниями к проведению тилт-теста с использованием изопротеренола являются ИБС, неконтролируемая гипертензия, сужение выводного отдела левого желудочка, достоверный стеноз аорты. С предосторожностями данный тест необходимо проводить у пациентов с подтвержденными аритмиями.
2.2.3. Электрокардиографический мониторинг (инвазивный и неинвазивный)
ЭКГ-мониторинг используется для диагностирования интермиттирующей бради- и тахиаритмии. В настоящее время доступны несколько видов ЭКГ-мониторинга в амбулаторных условиях: стандартный амбулаторный холтеровский ЭКГ-мониторинг, мониторинг в условиях стационара, регистратор событий, внешний или имплантированный петлевой регистратор и дистанционная телеметрия (в домашних условиях).
Золотым стандартом для диагностики синкопе является установление взаимосвязи между симптомами и задокументированной аритмией [3]. Некоторые авторы рассматривают бессимптомную достоверную аритмию, выявленную на основании наличия длительной асистолии (более 3 с), наджелудочковой тахикардии (более 160 уд/мин) или желудочковой тахикардии, в качестве диагностического критерия. Отсутствие во время синкопе задокументированной аритмии позволяет исключить последнюю как причину синкопе, однако не является специфическим диагностическим показателем.
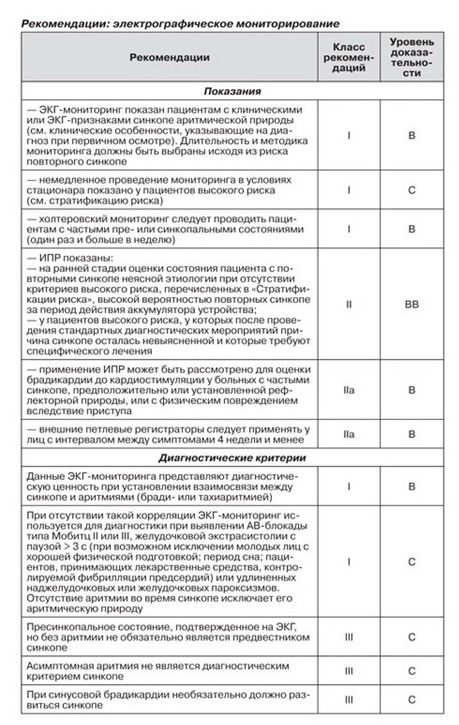
Как правило, ЭКГ-мониторинг показан только в тех случаях, когда существует высокая вероятность выявления аритмической этиологии синкопе во время фазы подготовки к тесту (см. стратификацию риска). Однако было показано, что аритмия (как правило, асистолия) во время синкопе встречается практически у 50 % лиц старше 40 лет с повторными эпизодами синкопе, без достоверного структурного поражения сердца, с нормальной картиной ЭКГ.
2.2.3.1. Мониторинг в условиях стационара
Мониторинг в условиях стационара показан при высокой вероятности развития у пациента жизнеугрожающей аритмии. ЭКГ-мониторинг на протяжении нескольких дней имеет диагностическую ценность у больных с ЭКГ-изменениями или клинически выраженными признаками, указывающими на аритимическую этиологию синкопе (см. стратификацию риска), особенно если мониторинг проводится сразу после синкопе. Однако в данных условиях диагностическая ценность ЭКГ-мониторинга составляет не более 16 % и его проведение вызвано необходимостью избежать непосредственного риска у данного пациента.
2.2.3.2. Холтеровский мониторинг
В современной практике для проведения холтеровского мониторинга используется стандартный 24–48-часовой или даже 7-дневный регистратор. Однако у большинства пациентов симптомы, как правило, не повторяются во время мониторинга. В связи с этим ценность холтеровского мониторинга снижается до 1–2 %. У 15 % симптомы не ассоциируются с аритмией [112]. Таким образом, у пациентов данной категории нарушения ритма могут быть потенциально исключены как причина синкопе. Сам по себе холтеровский мониторинг не является дорогостоящим методом, однако при использовании для диагностических целей у пациентов с синкопе его стоимость значительно возрастает. Данный метод имеет диагностическую ценность у больных с синкопе с частыми симптомами. Опыт подсказывает, что у данной когорты пациентов часто имеет место психогенное псевдосинкопе.
2.2.3.3. Внешние регистраторы событий в проспективном режиме
Регистратор события — это внешний прибор, который используется для оценки состояния пациента во время проявления симптомов. Данный тип регистратора достаточно информативен для пациентов с повышенной ЧСС [113], но не имеет диагностической ценности у больных с синкопе.
2.2.3.4. Внешние петлевые регистраторы
Этот тип приборов имеет петлевую память, позволяет регистрировать данные и отслеживать электрокардиограмму на протяжении длительного времени. Активируется пациентом обычно после наступления симптомов, что дает возможность обработать данные за 5–15 мин. Данный тип прибора подсоединяется к пациенту с помощью контактных электродов подкожно. В предыдущих исследованиях были показаны противоречивые результаты относительно пользы петлевых регистраторов: в одном исследовании было продемонстрировано, что применение данного типа приборов позволяет зарегистрировать ЭКГ-признаки синкопе приблизительно у 25 % включенных в исследование пациентов, у которых мониторинг проводился на протяжении месяца [114], тогда как в другом подтверждалась бесполезность применения таких регистраторов [115]. В последних публикациях есть сведения о необходимости сравнения данных, полученных при использовании петлевых регистраторов и холтеровского мониторинга, для увеличения диагностической ценности этих методов [116]. Однако пациенты придерживаются показаний обычно несколько недель, что недостаточно для выявления взаимосвязи между ЭКГ-признаками и синкопе у лиц с нечастыми эпизодами синкопальных состояний.
2.2.3.5. Имплантируемые петлевые регистраторы
Имплантируемые петлевые регистраторы (ИПР) имплантируются подкожно с применением местной анестезии. Запас заряда аккумулятора составляет около 36 месяцев. Данный прибор имеет петлевую память, что делает возможность сохранения записей ЭКГ в ретроспективном режиме. Прибор может быть активирован пациентом или кем-то
другим, обычно после эпизода синкопе [103, 104]. Также запись может быть активирована автоматически в случае раннего обнаружения аритмий [105–107]. Данные могут быть проанализированы в режиме on line. Преимуществами использования ИПР являются длительность и высокая точность регистрации ЭКГ-показателей. Однако есть и ряд недостатков, в частности необходимость хирургического вмешательства, пусть даже и незначительного, сложность распознавания наджелудочковой и желудочковой аритмии, возможность влияния состояния перевозбудимости или заторможенности на данные в карте памяти, а также высокая стоимость данного прибора. Вопрос относительно дороговизны данного метода может быть пересмотрен в разрезе его очень высокой диагностической ценности по сравнению со стандартными диагностическими мероприятиями. Однако для этого необходимо доказать достоверную возможность выявления взаимосвязи ЭКГ-признаков с синкопе именно с применением данного метода у большого количества пациентов [117, 118]. Сегодня, как правило, его используют в тех случаях, когда причина синкопе после проведения всех возможных стандартных диагностических мероприятий осталась невыясненной. За 5 месяцев наличия ИПР корреляция ЭКГ-признаков с синкопе была выявлена у 88 % пациентов из тщательно отобранной когорты [103]. При анализе 9 исследований [103, 104, 108, 119–124], включавших 506 пациентов с синкопе неясной этиологии после проведения стандартных методов обследования, было выявлено, что корреляция между ЭКГ-отклонениями и синкопе установлена у 176 (35 %) больных; из них у 56 % отмечалась асистолия (или брадикардия в нескольких случаях) во время зарегистрированного события, у 11 % — тахикардия и у 33 % не было выявлено аритмий. В семи исследованиях [104, 108, 119–123] было показано, что предсинкопальное состояние не ассоциировалось с аритмиями. Эти данные дают основание полагать, что при отсутствии задокументированной аритмии понятия пресинкопального и собственно синкопального состояний не являются взаимозаменяемыми. И наоборот, наличие подтвержденной аритмии в пресинкопальном состоянии является диагностическим маркером.
Кроме как при синкопе неясной этиологии, ИПР также применяются и в других случаях, что представляет интерес для медиков и исследователей:
— у пациентов с предполагаемой эпилепсией, у которых лечение оказалось неэффективным [90];
— у пациентов с предполагаемым нейроопосредованным синкопе (выяснение этиологии спонтанного синкопе может повлиять на характер лечения) [110];
— у пациентов с блокадой ножки пучка Гиса, у которых пароксизмальная АВ-блокада наиболее вероятна, несмотря на отрицательный ответ при проведении электрофизиологической оценки [120];
— у пациентов с подтвержденным структурным поражением сердца и/или непродолжительной желудочковой тахиаритмией, у которых желудочковая тахиаритмия наиболее вероятна, несмотря на отрицательный ответ при проведении электрофизиологической оценки [119];
— у пациентов с обмороками неясной этиологии.
2.2.3.6. Дистанционная (в домашних условиях) телеметрия
Не так давно были разработаны системы, внешние и имплантируемые, которые обеспечивают регистрацию ЭКГ-показателей (с петлевой памятью на 24 часа) на протяжении длительного времени и передают данные в сервисный центр по беспроводной связи. Суточные данные или данные, свидетельствующие о вероятности развития события, посылаются из центра врачу. Согласно полученным результатам, такая мобильная внебольничная система телеметрии имеет высокую диагностическую ценность у пациентов с синкопе или пресинкопе по сравнению с внешними петлевыми регистраторами, активируемыми самими больными [126]. Необходимо дальнейшее исследование потенциального значения данных систем для диагностического обследования пациентов с синкопе.
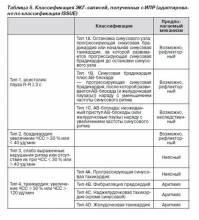
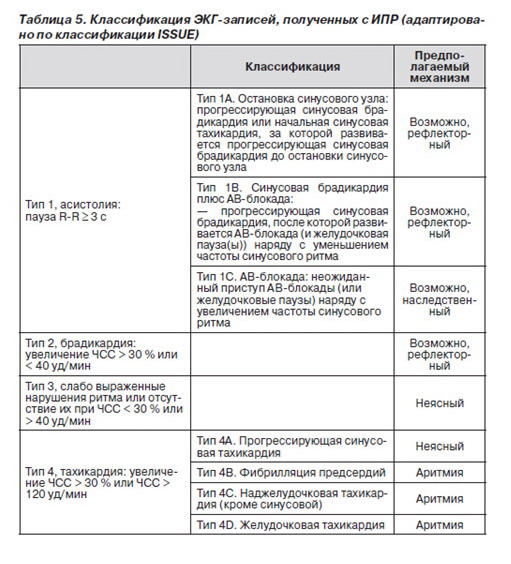
2.2.3.7. Классификация электрокардиографических записей
В связи с гетерогенностью признаков и вариабельностью нарушений ритма, зарегистрированных ИПР во время синкопе, исследователями Международного исследования синкопе неясной этиологии (International Study on Syncope of Unknown Etiology — ISSUE) была предложена классификация с целью структурировать методы обследования, что позволит выработать стандартный алгоритм, применимый в дальнейших исследованиях и клинической практике [127]. В данной классификации записи ЭКГ разделены на 4 группы. Отличительной характеристикой является основное изменение ритма и предполагаемый механизм в основе синкопе (табл. 5).
2.2.3.8. Электрокардиографический мониторинг при синкопе — когда использовать?
Нельзя полагаться только на данные ЭКГ-мониторинга. Врачам необходимо учитывать результаты первоначальной оценки состояния больного. В некоторых ситуациях, например, когда клинические данные достоверно указывают на рефлекторную природу синкопе и если имеют место нечастые эпизоды синкопе, в ЭКГ-мониторинге нет необходимости. У больных с частыми проявлениями симптомов или с синкопе предположительно аритмической природы, но не относящихся к группе высокого риска, возможно применение ИПР. ИПР применяются, как правило, тогда, когда не удалось выявить этиологию синкопе с помощью других диагностических методов. В одном из исследований [128] 60 пациентов были рандомизированы на 2 группы. В одной из них применяли стандартные диагностические методы, а именно внешние петлевые регистраторы, тилт-тест, электрофизиологическое исследование (ЭФИ); в другой группе диагностику проводили с использованием ИПР. Полученные результаты свидетельствуют о том, что применение ИПР в начальной диагностике имеет большую диагностическую ценность по сравнению со стандартными методами (52 и 20 % соответственно). Однако были исключены пациенты с высоким риском развития жизнеугрожающих аритмий и со сниженной фракцией выброса левого желудочка (35 %). Исходя из этих данных, а также с учетом ограниченных диагностических возможностей тилт-теста [98, 99], теста с использованием аденозинтрифосфата (АТФ), электрофизиологического обследования и непродолжительного ЭКГ-мониторинга (по Холтеру, с применением петлевых регистраторов) можно сделать вывод, что применение ИПР на ранней стадии диагностики должно быть стандартом при подозрении на аритмическую природу синкопе, если с помощью других методов не удается ее идентифицировать. Это поможет начать раннее этиологическое лечение.
В будущем будут разработаны системы, с помощью которых станет возможным регистрировать различные сигналы, кроме ЭКГ, и выделить признаки, характерные именно для спонтанных синкопальных состояний (в таком случае не будет необходимости провоцировать подобные состояния). В связи с этим вполне вероятно, что имплантированные регистраторы получат более широкое применение для выявления причин синкопе по сравнению со стандартными методиками. Однако у пациентов со структурным поражением сердца, которое обусловливает высокую вероятность развития жизнеугрожающей аритмии, предпочтение следует отдать имплантации электрического дефибриллятора или ИПР. Хотя подтвержденная брадиаритмия, сопровождающая синкопе, является диагностическим критерием, иногда необходимо проведение дополнительных тестов с целью дифференциации врожденных кардиологических отклонений и рефлекторного механизма синкопе. Последний часто является причиной пароксизмальной брадиаритмии у пациентов без структурного поражения сердца и нормальной картиной ЭКГ.
2.2.4. Электрофизиологическое исследование
Диагностическая эффективность ЭФИ при установлении причины синкопе во многом определяется предполагаемыми отклонениями, а также протоколом ЭФИ.
В обзоре 8 исследований, включавших 625 пациентов с синкопе, у которых провели ЭФИ [130], было показано, что позитивный результат был достигнут преимущественно у пациентов со структурными повреждениями сердца.
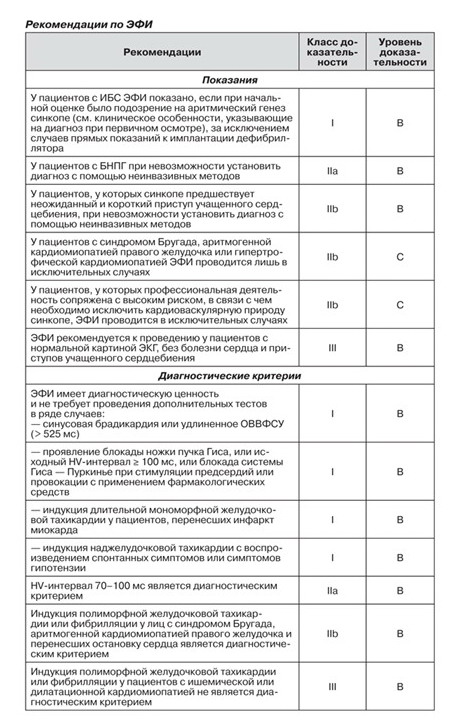
В целом данный метод не отличается высокой чувствительностью и специфичностью. В предыдущих рекомендациях подробно освещен этот вопрос. Более того, в последние годы были разработаны новые диагностические методы, например длительный мониторинг, которые являются более информативными. Следует также учесть, что ЭФИ больше не назначается пациентам с крайне сниженной фракцией выброса левого желудочка, потому что в данных случаях стоит вопрос об имплантации ЭКД независимо от причины синкопе. Согласно данным публикаций за последние годы, лишь 2 % больных с синкопе неясной этиологии кардиолог назначает ЭФИ. Врачи другой специальности назначают его еще реже [27, 31, 36, 40, 56, 131]. Тем не менее данный метод до сих пор применяется с диагностической целью в специфических клинических ситуациях, перечисленных ниже.
2.2.4.1. Предполагаемая интермиттирующая брадикардия
Врач с высокой достоверностью предположит брадикардию как причину синкопе до проведения специфических тестов при наличии бессимптомной синусовой брадикардии (< 50 уд/мин) или синусно-предсердную блокаду, которая обычно регистрируется на 12 отведениях ЭКГ или при ЭКГ-мониторинге.
Остается невыясненной диагностическая ценность удлиненного времени восстановления функции синусно-предсердного узла (ВВФСУ). Отклонением от нормы считается период > 1,6 или 2 с для ВВФСУ и > 525 мс для откорректированного времени восстановления функции синусно-предсердного узла (ОВВФСУ). В обсервационном исследовании была показана взаимосвязь между наличием удлиненного ВВФСУ при ЭФИ и влиянием стимуляции на симптомы. В другом небольшом проспективном исследовании было продемонстрировано, что у пациентов с ОВВФСУ > 800 мс риск развития синкопе в 8 раз больше, чем у больных с меньшим показателем [134].
2.2.4.2. Синкопальные состояния у пациентов с блокадами ножек пучка Гиса (включая атриовентрикулярные блокады высокой степени)
Для пациентов с БНПГ характерен высокий риск АВ-блокады. Два фактора обусловливают увеличение риска АВ-блокады у пациентов с БНПГ: синкопе в анамнезе и удлиненное время проведения из пучка Гиса в желудочки (HV-интервал). В зависимости от наличия синкопе в анамнезе риск АВ-блокады возрастает с 2 до 17 % в последующие 42 месяца. Вероятность АВ-блокады составляет 4, 12 и 24 % у пациентов с HV-интервалом < 55 мс (норма), > 70 мс и > 100 мс соответственно.
Развитие блокады ножек пучка Гиса в ответ на стимуляцию предсердий является важным предиктором угрозы АВ-блокады, но данный метод имеет низкую чувствительность.
Развитие блокады ножек пучка Гиса при применении антиаритмических препаратов I класса может также спровоцировать спонтанную АВ-блокаду. Прогностическая ценность фармакологически спровоцированного удлинения HV-интервала до уровня > 129 мс без АВ-блокады остается невыясненной. С другой стороны, примерно у 1/3 больных с отрицательным ответом при ЭФИ с имплантированным ИПР в последующем развилась АВ-блокада. Таким образом, ЭФИ имеет низкую чувствительность и специфичность.
Согласно проанализированным данным 9 исследований, в которых принял участие 1761 пациент, уровень общей смертности составил 28 % через 40 месяцев; в 32 % случаев отмечалась внезапная смерть. При этом следует отметить, что ни синкопе, ни удлиненный HV-интервал не ассоциировались с более высоким риском смерти, а терапия с использованием кардиостимулятора не уменьшала этот риск.
В заключение следует отметить, что применение метода удлинения HV-интервала или провокации АВ-блокады путем кардиостимуляции или фармакологического вмешательства позволяет выделить группу пациентов с более высоким риском развития АВ-блокады в последующем, при этом отсутствие отклонений не является поводом исключать данную возможность.
2.2.4.3. Предполагаемая тахикардия
У пациентов, у которых синкопе предшествует приступ учащенного сердцебиения (возможно, наджелудочковая тахикардия), ЭФИ может быть назначена для оценки точного механизма.
У пациентов с сохраненной фракцией выброса левого желудочка, перенесших инфаркт миокарда, выявить причину синкопе может помочь провокация длительной мономорфной желудочковой тахикардии. Индукция желудочковой фибрилляции не считается специфическим критерием. Отсутствие индуцированной желудочковой аритмии позволяет выделить группу пациентов, у которых аритмия является маловероятной причиной синкопе.
Сведения о пользе и целесообразности ЭФИ и провокационного теста с применением антиаритмических препаратов I класса у больных с синкопе и предполагаемым синдромом Бругада достаточно противоречивы. В метаанализе исследований, включавших 1036 участников, было установлено, что у 56 % из них не было необходимости провоцировать наджелудочковую или желудочковую фибрилляцию путем стимуляции желудочков, в течение последующих 34 месяцев не отмечалось какой-либо разницы в исходе [140].
2.2.5. Проба с применением аденозинтрифосфата
Проведение данного теста предполагает болюсное введение (< 2 с) 20 мг АТФ (или аденозина) во время ЭКГ-мониторинга. Отклонениями от нормы считаются АВ-блокада с длительностью асистолии желудочка более 6 с или АВ-блокада более 10 с. Патологический ответ на АТФ-пробу отмечался у некоторых пациентов с синкопе неясной этиологии (в основном у женщин пожилого возраста без структурных изменений сердца), однако в группе контроля такой ответ на пробу не был зарегистрирован. Полученные данные дают основание полагать, что пароксизмальная АВ-блокада может быть причиной синкопе неизвестного генеза. Тем не менее в последних исследованиях была установлена взаимосвязь между АВ-блокадой, спровоцированной АТФ-пробой, и изменениями на ЭКГ (полученные при помощи ИПР) во время спонтанного синкопе [98, 99]. Роль высвобождения эндогенного аденозина в развитии некоторых форм синкопе при пароксизмальной АВ-блокаде (так называемое аденозин-чувствительное синкопе) остается предметом исследований.
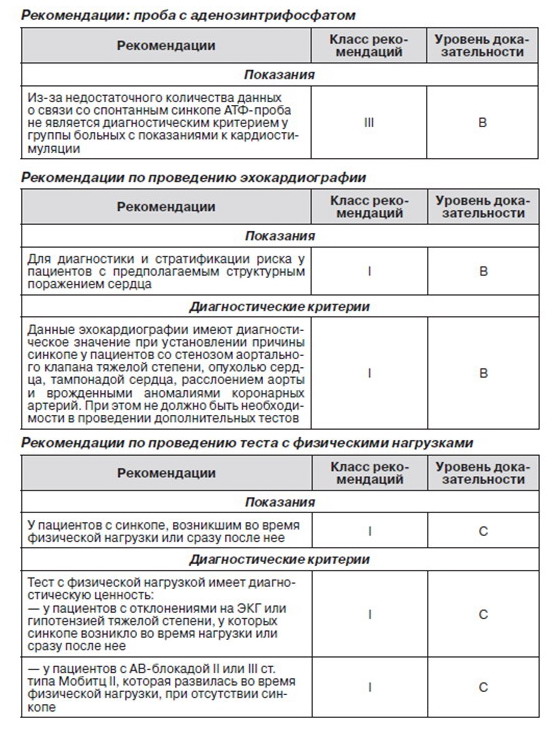
2.2.6. Эхокардиография и другие методы визуализации
Наиболее информативным методом диагностики структурного заболевания сердца является эхокардиография, включая оценку структурных и функциональных показателей гемодинамики. Данные эхокардиографии очень важны для стратификации риска при сниженной фракции выброса левого желудочка. При наличии структурной болезни сердца необходимо провести дополнительные тесты для выявления возможной кардиальной причины синкопе. С помощью метода эхокардиографии определить причину синкопе можно у незначительного количества пациентов, например, со стенозом аортального клапана, миксомой предсердия, тампонадой. Полагаться на ее данные можно лишь в том случае, если очевидно, что нет необходимости проводить дополнительные тесты.
В отдельных случаях (расслоение аорты и гематома, эмболия легочной артерии, опухоль сердца, болезни перикарда и миокарда, врожденные аномалии коронарных артерий) возможно проведение трансэзофагеальной эхокардиографии, компьютерной томографии, магнитно-резонансной томографии.
2.2.7. Тест с применением физических нагрузок
Синкопе, ассоциированное с физическими нагрузками, — достаточно редкое явление. Ввиду этого данный метод диагностики должен применяться лишь у тех, у кого эпизоды синкопе возникали во время физической нагрузки или сразу после нее. Необходима детальная запись ЭКГ и АД-мониторинг во время теста и в фазу восстановления, так как синкопе может возникнуть как во время нагрузки, так и сразу после нее. Поэтому эти данные необходимо рассматривать отдельно. Если синкопе развилось во время физической нагрузки, то вероятной его причиной может быть кардиальная (хотя в некоторых сообщениях говорится о проявлении значительного рефлекторного расширения сосудов). Механизм в основе синкопе, которое возникло сразу после нагрузки, скорее всего рефлекторный. Было показано, что АВ-блокада II или III ст., возникшая во время тахикардии на фоне нагрузки, развивается дистальнее АВ-узла и имеет прогрессирующий характер. Данные ЭКГ покоя редко бывают информативны для выявления нарушения внутрижелудочкового проведения [141]. Нет достоверных данных, согласно которым возможно было бы рекомендовать проведение теста с применением физических нагрузок в общей популяции больных с синкопе.
2.2.8. Зондирование сердца
Метод зондирования сердца должен применяться лишь при подозрении на ишемию миокарда и при исключении аритмий вследствие ишемии.
2.2.9. Оценка психического состояния
Существуют два возможных механизма, связывающих синкопе и состояние психического здоровья. Во-первых, прием многих психиатрических препаратов может вызвать синкопе из-за развития ОГ или синдрома удлиненного интервала QT. Прекращение приема препаратов данной категории может иметь очень значимые последствия, поэтому этот момент должен быть обязательно учтен.
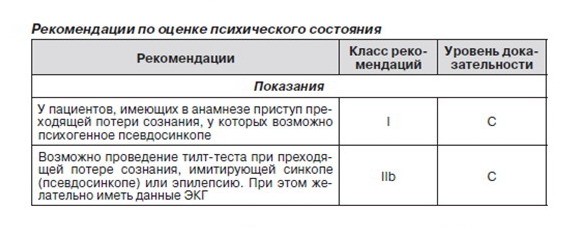
Во-вторых, возможны так называемые функциональные приступы. Под понятием «функциональные» подразумеваются состояния, похожие на соматические. При этом невозможно объяснить их соматический механизм, однако психологический очевиден. Можно выделить 2 группы пациентов для дифференциальной диагностики потери сознания. В обеих группах пациенты не контролируют свои движения и не отвечают на внешние раздражители. В одной из групп макродвижения похожи на таковые при эпилептических судорогах; такие приступы рассматривают как псевдоэпилепсию, приступы неэпилептического характера, психогенные неэпилептические приступы. В другой группе макродвижений не отмечается, поэтому приступы похожи на синкопе или длительную потерю сознания. Они получили название психогенных синкопе, псевдосинкопе, синкопе психиатрического происхождения, синкопе неясной этиологии. Следует отметить, что последние два термина не соответствуют определению синкопе, поскольку при функциональной потере сознания не отмечается церебральной гипоперфузии.
Важным различием между функциональной потерей сознания и похожим состоянием является отсутствие соматического механизма: при псевдоэпилепсии не регистрируется эпилептиформная активность мозга, не снижены АД и ЧСС, на электроэнцефалограмме не зафиксирована дельта-активность во время приступа.
Достоверно неизвестна частота подобных приступов, в значительной степени она зависит от медицинского учреждения. Так, в специализированных клиниках частота функциональных потерь сознания, подобных эпилепсии, варьирует от 15 до 20 %, а в клиниках синкопе она составляет 6 % [142].
Диагностика
Псевдосинкопе, как правило, длится дольше, чем синкопе: пациенты могут лежать на полу несколько минут, иногда до 15 мин и более. Также для него характерна высокая частота приступов, до нескольких раз в день, и практически отсутствие четко определяемых триггерных факторов. При функциональной преходящей потере сознания также возможно физическое повреждение (приблизительно в 50 % случаев). При эпилептическом синдроме и синкопе глаза, как правило, открыты, при функциональной потере сознания обычно закрыты. Может быть полезным фиксирование данных при приступе: показатели мышечного тонуса (видеозапись или неврологическое обследование), АД, ЧСС, ЭКГ. Последнее вполне возможно осуществить, поскольку функциональные нарушения легко распознаются и их выявление поможет поставить точный диагноз [142]. Такие данные, полученные при тилт-тесте, как потеря сознания с утратой контроля движений, нормальный уровень АД, ЧСС и нормальная картина ЭКГ, позволяют исключить синкопе и большинство форм эпилепсии.
Выявление природы синкопе очень важно для постановки правильного диагноза. Объяснить пациенту, что его заболевание имеет психогенный характер, достаточно сложно. Это может заставить пациента думать, что он лично несет ответственность за то, что с ним происходит, или что все считают, будто он симулирует приступы. Однако сам больной воспринимает их как нечто непроизвольное, и это на самом деле так. Поэтому необходимо в разговоре с больным подчеркнуть непроизвольность приступов потери сознания. Все это позволит выбрать правильное лечение.
2.2.10. Неврологическая оценка
В данном разделе рассматриваются неврологические нарушения как возможная причина синкопе или состояний, похожих на него, а также неврологические тесты для выявления данных состояний.

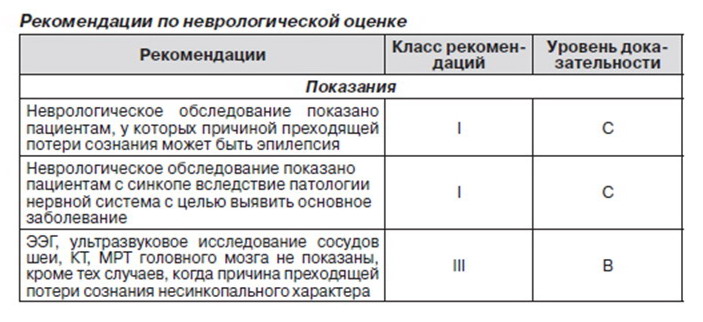
2.2.10.1. Клинические условия
Патология вегетативной нервной системы
Врача должны насторожить ранняя импотенция и нарушение мочеиспускания. Также у пациента могут быть выявлены болезнь Паркинсона или атаксия. При вторичной патологии вегетативной нервной системы и препаратиндуцированной ОГ следует учитывать характер назначенного лечения.
Цереброваскулярные заболевания
Синдром подключичного обкрадывания заключается в перераспределении крови из системы церебральных артерий в пользу артерий верхних конечностей при окклюзии начального отдела подключичной артерии. При сильной физической нагрузке на руку происходит сильный отток крови в конечность в ущерб головному мозгу. Вследствие этого может развиться транзиторная ишемическая атака. Синдром обкрадывания, как правило, встречается с левой стороны. Обычно его диагностируют при УЗИ, но в большинстве случаев он протекает бессимптомно (64 %) [114]. ТИА ассоциируется с синдромом обкрадывания, если имеет вертебробазилярную локализацию и ей предшествовала сильная физическая нагрузка на руку. Нет достоверных данных об изолированной потере сознания при отсутствии неврологических симптомов и признаков синдрома подключичного обкрадывания.
ТИА не является причиной синкопе, если развилась в области кровоснабжения сонных артерий. Крайне редко возникают потери сознания в случае окклюзии почти всех церебральных артерий и транзиторной обструкции других сосудов (практически всегда в положении стоя). Кроме того, всегда преобладают локальные неврологические симптомы.
Потеря сознания может возникнуть при ТИА в вертебробазилярном бассейне, но тогда всегда очевидны локальные признаки, в частности слабость в конечностях, нарушения походки, движений в конечностях, глазодвигательные нарушения, орофарингеальная дисфункция. ТИА всегда сопровождается неврологическим дефицитом и редко потерей сознания, синкопе же наоборот.
Мигрень
Синкопе часто встречается у лиц, страдающих мигренью. У пациентов данной категории синкопальные и мигренозные приступы, как правило, не совпадают во времени.
Эпилепсия
Эпилепсия может быть причиной преходящей потери сознания: пациенты не отвечают на внешние раздражители, падают, не помнят, что с ними произошло. Однако потеря сознания характерна только для таких форм эпилепсии, как клоническая, тонико-клоническая, атоническая генерализованная. При абсансной эпилепсии у детей и комплексной у взрослых характер сознания видоизменяется, однако не отмечается потери сознания. Эти больные сохраняют вертикальное положение при приступе, что невозможно при потере сознания.
Если при бессознательном состоянии наблюдаются отсутствие реакции, вялость, то следует исключить эпилепсию. Единственным исключением является атоническая форма эпилепсии, но она встречается редко. Такое состояние возникает у детей, у которых уже были неврологические расстройства, и, как правило, без триггерных факторов. Непроизвольные движения могут быть как при эпилепсии, так и при синкопе. При эпилепсии двигательная активность наблюдается приблизительно 1 мин, а при синкопе — несколько минут. Судороги при эпилепсии ярко выраженные, ритмичные, синхронные, тогда как при синкопе асинхронные, мало выраженные и неритмичные. Однако и при синкопе могут отмечаться синхронные судороги. При синкопе непроизвольные движения наблюдаются только после приступа и падения, что не характерно для эпилепсии.
Синкопе обычно предваряется триггерными факторами, эпилепсия — редко. Триггерные факторы для эпилепсии и синкопе различны. В первом случае это может быть мерцание света. Для ауры свойственно усиливающееся ощущение дискомфорта в животе и/или необычных неприятных запахов. При синкопе также возможна эпигастральная аура. Для эпилепсии не характерна потливость или бледность. При эпилепсии часто встречается прикусывание языка. Недержание мочи встречается как при эпилепсии, так и при синкопе. После приступа эпилепсии больной долго не может сориентироваться, после эпизода синкопе человек, как правило, достаточно быстро приходит в себя (табл. 6). Также для эпилепсии в большей мере по сравнению с синкопе характерны головная боль, боль в мышцах, повышение уровня креатининкиназы и пролактина.
Другие приступы
Катаплексия сопровождается парезом или параличом. Вызвана обычно сильными эмоциями, часто смехом. Человек находится в сознании, а значит, нет периода беспамятства. Если наряду с катаплексией отмечается дневная сонливость, то диагностируют нарколепсию.
При синкопе возможны падения; некоторые пожилые люди не осознают того факта, что теряли сознание. Иногда отмечается нарушение походки, равновесия, что похоже на падение при синкопе.
Термин «дроп-атака» применяется при болезни Меньера, атонических формах эпилепсии и падениях неясной этиологии. Чаще всего он применяется по отношению к женщинам среднего возраста (реже мужчинам), которые не помнят факта падения, а очнулись уже на полу [148]. Они помнят лишь о своем падении на пол. Врачи должны обратить особое внимание на жалобы больного на падения по неясной причине.
2.2.10.2. Неврологические тесты
Электроэнцефалография
При синкопе показатели ЭЭГ в межприступный период в пределах нормы [5, 149]. Однако данный факт не исключает эпилепсии. Очень важно учитывать клиническую картину. При неясности ситуации не следует торопиться с диагнозом эпилепсии.
Проведение ЭЭГ не рекомендуется при вероятном диагнозе синкопе, но если предполагается эпилепсия как причина падения, то проводить ЭЭГ обязательно, особенно если клиническая картина стертая. Данные ЭЭГ также могут быть полезны для выявления психогенного псевдосинкопе, если они зарегистрированы во время спровоцированного приступа.
Компьютерная томография и МРТ
Нет исследований по оценке значимости данных методов нейровизуализации при синкопальных состояниях. Следует избегать применения КТ и МРТ при неосложненных синкопе. Данные методы показаны только при проведении неврологического обследования.
Исследования сосудов мозга
Нет достоверных данных о необходимости проведения допплеровской ультрасонографии и ее диагностической ценности у пациентов с типичным синкопе.
Уровень смертности при обмороках сердечного происхождения достигает 10 %.

50-летнюю Нину Михайловну «скорая» привезла в больницу с диагнозом судороги. Она проснулась среди ночи с сильной болью в животе. На глазах у мужа стала пепельно-серой, буквально обливалась потом… И тут вдруг потеряла сознание. Перестала дышать. Только через пару минут постепенно стала приходить в себя. Муж Нины Михайловны рассказал врачам, что судорог и прикусов языка во время и после приступа у жены не было, как не было и послеобморочной спутанности сознания. Сказал еще, что несколько лет назад, когда у нее свело икроножную мышцу, она точно так же теряла сознание.
После обследования пациенте поставили диагноз: сосудистый обморок, спровоцированный болью.
Второй случай. Пенсионер Даниил Ильич в последние месяцы падал в обморок даже несколько раз. Все начиналось со звона в ушах, и потом он на секунды отключался. Тут надо сказать и о прошлом «опыте» мужчины: два инфаркта, один инсульт.
После последнего обморока больного госпитализировали. У него был очень редкий пульс. Пациента уложили на койку, а вскоре он пробормотал медсестре: «Я ухожу…» На ЭКГ-мониторе в тот момент была долгая пауза — отсутствие сокращений сердца… Сейчас Даниил Ильич живет с водителем ритма — электрокардиостимулятором, который обеспечивает ему пульс нужной частоты.
Людей с обмороками не так и мало. И часто врачи в замешательстве: необъяснимые потери сознания. Могут, например, списать на трудноизлечимую эпилепсию. Тогда, увы, больные лечатся с неверным диагнозом. Очень часто таким диагнозом страдают дети.
У 12-летнего Никиты с пяти лет частые обмороки. Все это время он наблюдался у неврологов как эпилептик. Получал противосудорожные препараты, все большими и большими дозами. Без эффекта. При плановом медосмотре электрокардиограмма ребенка привлекла внимание аритмологов. Оказалось, эпилепсия тут ни при чем. Причина — в электрической аномалии в сердце. А проявляется она так: сердце иногда полностью останавливается, обычно после «залпов» быстрого, до 200 ударов в минуту, пульса. Теперь Никите помогает имплантированный кардиовертер-дефибриллятор. Прибор распознает опасные аритмии и тут же прерывает их, не давая сердцу «захлебнуться» в патологическом ритме.
Итак, обморок. Все знают, что это такое, но не все знают, почему так происходит. Потому что мозг вдруг не получает достаточно крови и кислорода. Почти у 50 % взрослых хотя бы раз в жизни случался обморок (кстати, его медицинский термин — синкоп). Вообще, из всех пациентов, обращающихся за неотложной помощью, больше 3 % — те, кто страдает синкопальными состояниями. Конечно, случаются обмороки и у почти здоровых людей. Провоцируются они, например, сильным испугом, болью, духотой, переутомлением, нагрузками. Но есть и куда более серьезные «провокаторы». В 10 % случаев за обмороками скрываются болезни сердца: кардиомиопатия, миокардит, врожденный порок сердца, а еще так называемые первичные электрические болезни сердца, при которых без явных признаков поражения сердечной мышцы может развиться жизнеугрожающая аритмия, говорит хирург, аритмолог, кардиолог 9-й клинической больницы Минска Сергей Моисеенко (на снимке).
Уровень смертности при обмороках сердечного происхождения достигает 10 % (более половины их связано с аритмией). В случае невыясненных причин синкопальных состояний смертность — 36,6 %.
Пациенты после обморока госпитализируются с самыми разными диагнозами. Определить истинные причины случившегося, утверждают доктора, порой непросто даже после тщательнейшего обследования. И в 25 % случаев эти причины остаются, увы, так и невыясненными, а пациент продолжает при этом сильно рисковать. Рискует, например, развить жизнеугрожающую аритмию, что может закончиться синдромом внезапной смерти. Или получить рецидивы пусть и менее фатальных, но тоже опасных обмороков. Наконец, при потере сознания можно попросту травмироваться. Упал, очнулся — разбитая голова. Или же представьте: человек «нырнул» в обморок прямо на рабочем месте, а работа его связана с высотой или движущимися механизмами...
Как видно, обмороки — проблема серьезная. А раз есть проблема — должно быть и решение, то есть своевременная диагностика и выбор правильной терапии этого опасного явления.
— Создать центр обморочных состояний — эту идею я вынашиваю несколько лет. В России, например, подобное учреждение работает уже давно, — рассказывает Сергей Моисеенко. — Есть идеи организовать такой центр на базе 9-й больницы или Минского консультационно-диагностического центра. Планируется привлечь специалистов, диагностические службы и оборудование из разных клиник. Пока в стране нет отдельных специалистов, занимающихся именно обмороками, а в кадровом реестре нет и такой специальности, как синкополог.
Даже после полного осмотра пациенту центра, если понадобится, назначат дополнительные исследования. То есть врачи будут делать все, чтобы определить-таки истинную причину болезни. А в случаях, когда в короткие сроки это сделать все же не удастся, пациента внесут в специальную базу данных, он будет регулярно наблюдаться специалистами до тех пор, пока не определят природу его синкопальных эпизодов. Ни один не уйдет после обследования, не получив ответов на свои вопросы, подчеркивает Сергей Моисеенко.
Сейчас создается виртуальный прототип центра. Он соберет внушительную библиотеку материалов, посвященных проблеме обмороков. Люди смогут бесплатно проконсультироваться онлайн, расшифровать ЭКГ и получить разную информацию о своем сердечно-сосудистом здоровье.

