Синдром удлиненного интервала QT



Врожденные желудочковые нарушения ритма сердца
В настоящее время выделяют две основные причины врождённых желудочковых нарушений ритма сердца — так называемую «первичную электрическую болезнь сердца» («primary electric heart disease»), которую обнаруживают у лиц, не имеющих признаков органической патологии сердечно-сосудистой системы, и врождённые структурные заболевания сердца.
Основной причиной генетически детерминированных желудочковых аритмий при «первичной электрической болезни сердца» является дисфункция ионных каналов и насосов, играющих важнейшую роль в процессах деполяризации и реполяризации. Нарушение функции ионных каналов может быть обусловлено мутацией в генах основных порообразующих α-субъединиц, добавочных субъединиц, осуществляющих регуляцию их функции, белков-переносчиков, необходимых для транспортировки молекул, а также вспомогательных белков, опосредующих «встраивание» молекул в биологические мембраны и взаимодействие с клеточными структурами.В англоязычной литературе данные состояния обозначают также термином «каналопатии» («channelopathies»). К ним относят синдром удлиненного интервала QT, синдром Бругада, синдром укороченного интервала QT и катехоламин-зависимую полиморфную желудочковую тахикардию. Общими клиническими проявлениями данных заболеваний являются приступы потери сознания, обусловленные рецидивами желудочковой тахикардии (ЖТ), чаще полиморфной, преимущественно типа «пируэт» (Torsade de Pointes [TdP]), случаи внезапной сердечной смерти (ВСС) при отсутствии признаков структурного заболевания сердца и наследственный характер заболевания.
Существует целый ряд наследственных структурных заболеваний сердца, проявляющихся тяжелыми желудочковыми тахиаритмиями и случаями ВСС, наличие которых может быть ведущим клиническим симптомом заболевания, определяющим прогноз жизни пациента. Наиболее распространёнными из них являются гипертрофическая и дилатационная кардиомиопатии, а также аритмогенная дисплазия–кардиомиопатия правого желудочка (АДПЖ), которая требует отдельного рассмотрения.
Синдром удлиненного интервала QT
Врождённый синдром удлиненного интервала QT
Наследственный синдром удлинённого интервала QT (СУИQT, в англоязычной литературе — Long QT syndrome — LQTS или LQT) является наиболее частым и наиболее изученным из данных заболеваний, проявляющимся удлинением интервала QT на ЭКГ [при отсутствии других вызывающих это изменение причин], рецидивирующими синкопальными и пресинкопальными состояниями вследствие пароксизмов TdP, а также случаями внезапной сердечно-сосудистой смерти.
Эпидемиология
Распространенность заболевания в популяции составляет около 1:2000 новорождённых. Следует отметить, что эти данные учитывают только случаи «явного» увеличения продолжительности интервала QT, выявленного при регистрации ЭКГ. У некоторых больных симптомы заболевания могут полностью отсутствовать в течение всей жизни и проявляться лишь при возникновении дополнительных факторов, способствующих удлинению интервала QT, например гипокалемии, или при назначении лекарственных препаратов, способных увеличивать длительность интервала QT. Кроме того, удлинение интервала QT может носить преходящий характер, следовательно, истинная распространённость данного заболевания в популяции, по-видимому, ещё больше.
Этиология
Основной причиной СУИQT является дисфункция ионных каналов и насосов, приводящая к увеличению продолжительности фаз реполяризации кардиомиоцитов. Нарушение функции ионных каналов может быть обусловлено мутацией в генах основных порообразующих α-субъединиц, добавочных субъединиц, осуществляющих регуляцию их функции, белков-переносчиков, необходимых для транспортировки молекул, а также вспомогательных белков, опосредующих «встраивание» молекул в биологические мембраны и взаимодействие с клеточными структурами.
Классификация и клинические проявления
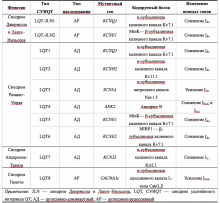
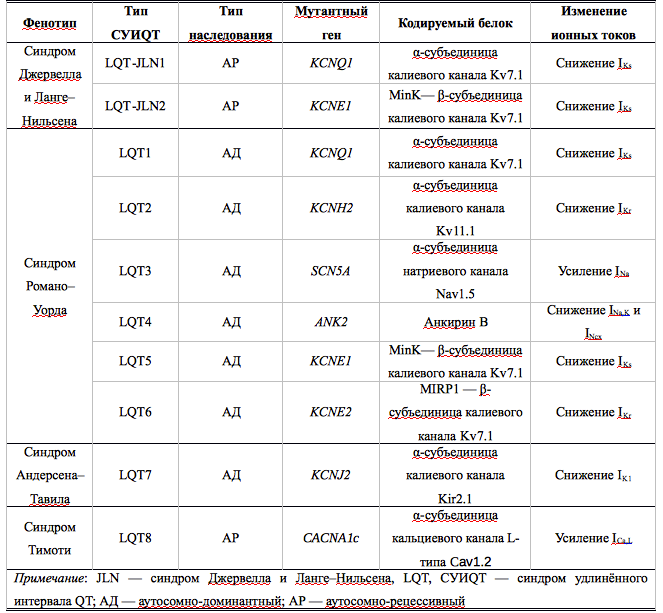
В табл. 1 представлена генетическая классификация синдрома удлиненного интервала QT: указаны гены, мутации в которых обнаруживают при соответствующих типах заболевания, кодируемые данными генами белки и изменения ионных токов, приводящие к удлинению фаз реполяризации. Следует отметить, что при проведении молекулярно-генетического скрининга больных СУИQT примерно в 25% случаев генетические нарушения не обнаруживают, что позволяет ожидать в дальнейшем выявление новых генетических мутаций, приводящих к возникновению заболевания.
Таблица 1. Молекулярно-генетические типы наследственного синдрома удлинённого интервала QT
Описаны следующие фенотипические формы синдрома удлиненного интервала QT: синдром Романо–Уорда (Romano–Ward), синдром Джервелла и Ланге–Нильсена (Jervell and Lange-Nielsen), синдром Андерсена–Тавила (Andresen–Tawil) и синдром Тимоти (Timothy).
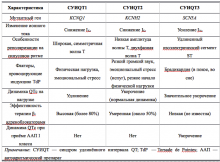
Наиболее распространённая форма заболевания с аутосомно-доминантным типом наследования — синдром Романо–Уорда (Romano–Ward), характерными клиническими проявлениями которого являются увеличение продолжительности интервала QT, рецидивирующие синкопальные состояния, чаще всего обусловленные полиморфной желудочковой тахикардией (ЖТ) типа пируэт, и наследственный характер заболевания. Более 90% случаев синдрома Романо–Уорда представлены СУИQT 1-го (СУИQT1), 2-го (СУИQT2) и 3-го (СУИQT3) типов, имеющих особенности клинических и электрокардиографических проявлений (табл. 2, рис. 1).
Таблица 2. Клиническая характеристика основных типов наследственного синдрома удлинённого интервала QT.
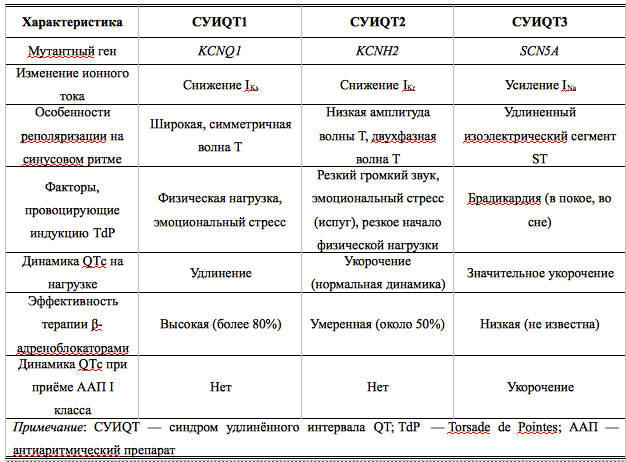
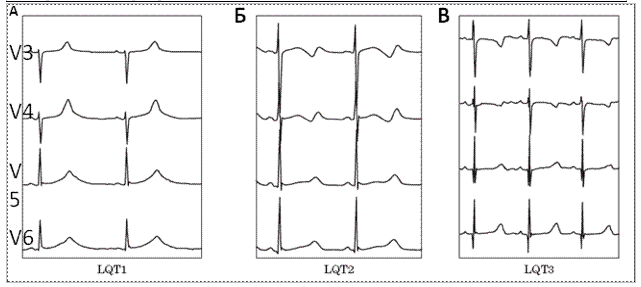
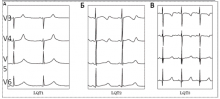
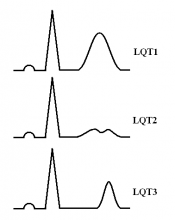
Рис. 1. Изменения ЭКГ при различных типах наследственного синдрома удлиненного интервала QT: (А) — широкая гладкая волна T при СУИQT1; (Б) — двухфазная T-волна при СУИQT2; (В) — низкоамплитудная и укороченная T-волна с удлиненным, горизонтальным ST-сегментом при СУИQT3.
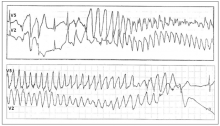
СУИQT1 — наиболее распространенный тип синдрома, обусловленный мутацией в гене KCNQ1, кодирующем α-субъединицу калиевого канала, генерирующего ток IKs, который является основным током реполяризации при высокой частоте сердечного ритма. Снижение силы IKs приводит к недостаточному укорочению интервала QT при нарастании частоты сердечных сокращений. По этим причинам больным СУИQT1 характерно возникновение TdP на фоне физической нагрузки (рис. 2) и эмоционального стресса. Особенностью ЭКГ при СУИQT1 является удлиненная и гладкая волна Т (см. рис. 1А).
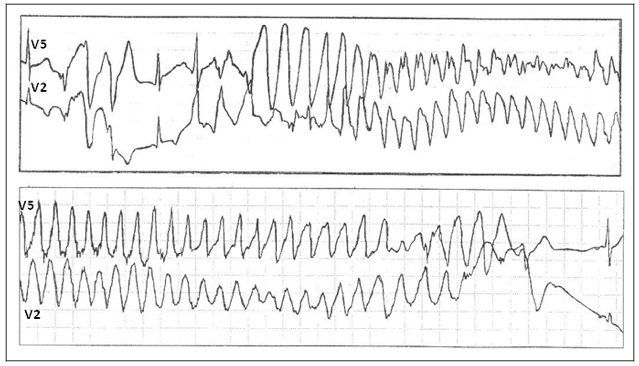
Рис. 2. Развитие пароксизма полиморфной желудочковой тахикардии типа Torsade de Pointes на фоне физической нагрузки у больной синдромом Романо–Уорда (фрагмент непрерывной записи суточного мониторирования ЭКГ по Холтеру).
Причиной СУИQT2 является мутация в гене KCNH2, кодирующем α-субъединицу калиевого канала Kv11.1, генерирующего ток IKr. При СУИQT2 пароксизмы TdP могут возникать как во время нагрузки, так и в покое. Характерным провоцирующим фактором является резкий громкий звук. На ЭКГ больных СУИQT2 регистрируют непротяженную, двухфазную волну Т (см. рис. 1Б).
СУИQT3 является менее распространённой формой заболевания, обусловленной мутацией в гене SCN5A, кодирующем α-субъединицу натриевого канала, что приводит к нарушению инактивации натриевых каналов, продолжающемуся вхождению ионов Na+ в клетку и увеличению продолжительности реполяризации кардиомиоцитов. TdP у больных СУИQT3 возникают на фоне брадикардии, преимущественно во время сна. Физические нагрузки, напротив, переносятся хорошо и сопровождаются укорочением интервала QT. Характерной особенностью ЭКГ у данных больных является удлиненный сегмент ST с отсроченным началом непродолжительной низкоамплитудной волны Т (см. рис. 1В).
Существенно реже встречается аутосомно-рецессивная форма заболевания (синдром Джервелла и Ланге–Нильсена), для которой характерны врождённая нейросенсорная тугоухость, более выраженное увеличение длительности интервала QT и большая частота опасных для жизни желудочковых аритмий. Заболевание обусловлено мутациями в генах KCNQ1 или KCNE2, кодирующих основную и добавочную субъединицы потенциал-зависимых калиевых каналов Kv7.1, приводящими к снижению силы тока IKs.
Синдром Андерсена–Тавила — редкая форма заболевания, при которой удлинение интервала QT сопровождается появлением волны U, пароксизмами как полиморфной желудочковой тахикардии типа TdP, так и двунаправленной желудочковой тахикардии. В 60% случаев заболевание обусловлено мутацией в гене KCNJ2, кодирующем α-субъединицу калиевых каналов аномального входящего выпрямления Kir2.1, генерирующих ток IK1, сила которого снижается. В 40% случаев генетический дефект в настоящее время обнаружить не удаётся. Характерные экстракардиальные проявления заболевания, такие как, аномалии развития костной системы (низкорослость, микрогнатия, большое расстояние между глазницами, низкое расположение ушных раковин, сколиоз, клинодактилиия), гипокалемия и периодический калий-зависимый паралич, присутствуют не у всех больных. Синдром Андерсена–Тавила — заболевание с аутосомно-доминантным типом наследования, однако семейный характер заболевания прослеживается далеко не всегда, в связи с трудностями диагностики, неспецифическими клиническими проявлениями заболевания и неполной пенетрантностью мутантных генов. До 50% случаев заболевания обусловлены мутацией de novo
Синдром Тимоти — крайне редкая форма СУИQT, обусловленная мутацией в гене CACNA1c, кодирующем α-субъединицу кальциевых каналов CaV1.2. При данном синдроме отмечают наиболее выраженное удлинение интервалов QT и QTc (до 700 мс), сопровождающееся крайне высоким риском внезапной сердечно-сосудистой смерти (средняя продолжительность жизни составляет 2,5 года). До 60% больных имеет различные врождённые пороки сердца [открытый артериальный проток, тетраду Фалло, открытое овальное окно и дефекты межжелудочковой перегородки] и различные нарушения проводимости (характерны преходящая и постоянная формы АВ блокады II степени с проведением на желудочки 2:1). Среди экстракардиальных проявлений заболевания описаны когнитивные нарушения (задержка психомоторного развития, аутизм), гипогликемия, иммунодефициты, аномалии строения лица (сглаженность носогубной складки, низкое расположение ушных раковин), а также частичное или полное сращение пальцев кистей и стоп (синдактилия). Синдром Тимоти наследуется по аутосомно-доминантному типу, однако подавляющее большинство случаев заболевания обусловлено мутацией de novo.
Диагностика
Критерии, применяемые для постановки диагноза наследственного СУИQT, предложенные J.P. Schwarz, представлены в табл. 3.
Таблица 3. Диагностические критерии наследственного синдрома удлинённого интервала QT (в соответствии с изменениями 2006г.).

Наследственный СУИQT диагностируют в случае, если сумма баллов составляет ≥3,5, при наличии подтверждённой молекулярно-генетическими методами мутации, приводящей к увеличению продолжительности интервала QT, при повторной регистрации на ЭКГ удлинения интервала QTc ≥600 мс в случае отсутствия других причин удлинения интервала QT.
Диагноз наследственного СУИQT может быть также поставлен при повторной регистрации на ЭКГ удлинения интервала QTc до 480–499 мс у пациентов с синкопальными состояниями неясного генеза, при отсутствии генетической мутации и других причин удлинения интервала QT.
Методы молекулярно-генетической диагностики имеют большое значение в диагностике СУИQT и определении прогноза больных. При проведении комплексных генетических анализов мутации удаётся обнаружить приблизительно у 75% больных, поэтому отрицательный результат генетического анализа не позволяет полностью исключить диагноз СУИQT.
Проведение комплексного генетического анализа на выявление возможных мутаций в генах KCNQ1 KCNH2 и SCN5A (СУИQT 1, 2 и 3-го типов — наиболее распространённые формы заболевания) рекомендовано всем больным, имеющим клинические проявления СУИQT, отягощённый семейный анамнез и удлинение интервала QTc, зарегистрированное на ЭКГ в покое или при проведении провокационных диагностических проб, а также всем пациентам, не имеющим характерных СУИQT симптомов, при регистрации на ЭКГ удлинения интервала QTc >500 мс при отсутствии других возможных причин удлинения интервала QT.
Проведение комплексного генетического анализа на выявление возможных мутаций в генах KCNQ1 KCNH2 и SCN5A может иметь смысл у пациентов, не имеющих характерных СУИQT симптомов, при регистрации на ЭКГ удлинения интервала QTc >480 мс при отсутствии других возможных причин удлинения интервала QT.
В случае обнаружения у больного СУИQT генетической мутации проведение скрининга, направленного на выявление этой мутации, рекомендовано всем близким родственникам, даже при отсутствии у них характерных этому заболеванию клинических проявлений и изменений ЭКГ.
Поскольку удлинение интервала QT может носить преходящий характер, в диагностике заболевания имеют значение продолжительная регистрация ЭКГ (например, суточное мониторирование ЭКГ по Холтеру; данный метод особенно информативен у больных СУИQT 2-го и 3-го типов, поскольку у больных этими формами заболевания наибольшее увеличение длительности интервала QT отмечают обычно в ночное время) и провокационные пробы.
В целях обеспечения безопасности пациента и повышения диагностической значимости, существует ряд требований, которые должны быть учтены при проведении данных диагностических исследований. Поскольку в ходе исследований возможна индукция опасных для жизни нарушений ритма сердца, все провокационные пробы должны проводиться опытным медицинским персоналом при непрерывной регистрации ЭКГ (следует производить мониторирование ЭКГ до полной нормализации индуцированных в ходе исследования изменений ЭКГ, при проведении фармакологических провокационных проб — не менее 30 мин после окончания введения препарата) и систематическом измерении АД больного, в условиях непосредственной доступности необходимого для сердечно-легочной реанимации оборудования [включая дефибриллятор] и возможности незамедлительного вызова врача-реаниматолога. Проведение нагрузочных проб должны осуществлять физически тренированные сотрудники, способные уберечь пациента от падения в случае возникновения гемодинамического коллапса при индукции желудочковых аритмий.
Провокационные пробы далеко не всегда вызывают типичные для конкретного заболевания изменения ЭКГ. Пограничные изменения не должны расцениваться как диагностически значимые. В случае пограничных изменений ЭКГ или отрицательного результата исследования при большой вероятности заболевания (характерная клиническая картина, результаты генетических исследований) целесообразно проведение другой провокационной пробы.
Для выявления СУИQT используют следующие провокационные пробы.
- Активная ортостатическая проба. Оценка динамики интервала QT при регистрации ЭКГ в ходе ортостатической пробы обладает диагностической значимостью, позволяя в ряде случаев выявить больных СУИQT. После перехода в вертикальное положение отмечается умеренное увеличение частоты синусового ритма, при этом у здоровых пациентов длительность интервала QT уменьшается, а у больных СУИQT (особенно 2-го типа) продолжительность интервала QT уменьшается менее существенно, не изменяется или увеличивается.
- Проба с дозированной физической нагрузкой на велоэргометре или тредмиле. Наиболее информативна оценка длительности интервала QT в период восстановления. Длительность интервала QTc >445 мс в конце периода восстановления (спустя 4 минуты после окончания нагрузки) характерна для больных СУИQT 1-го и 2-го типов. При этом длительность интервала QTc <460 мс в начале периода восстановления позволяет отличить больных СУИQT 2-го типа от больных СУИQT 1-го типа.
Фармакологические провокационные пробы.
- Проба с адреналином (эпинефрином). Позволяет выявить больных СУИQT1, поскольку при этой форме заболевания при проведении инфузии адреналина отмечается парадоксальное увеличение длительности интервала QT. Предложены 2 протокола проведения данной пробы: протокол Шимицу (Schimizu), в ходе которого вслед за болюсным введением осуществляется кратковременная инфузия адреналина, и протокол Мейо (Mayo), в соответствии с которым осуществляется внутривенная инфузия постепенно увеличиваемой дозы адреналина. Оба этих протокола обладают сопоставимыми чувствительностью и специфичностью, хорошо переносятся и редко сопровождаются нежелательными реакциями. Проба расценивается как положительная при увеличении длительности интервала QT >30 мс на фоне инфузии адреналина в дозе до 0,1 мкг/кг в мин. Следует отметить, что правильное измерение длительности QT на фоне инфузии адреналина часто затруднено изменениями морфологии зубцов T, особенно если при этом регистрируются высокоамплитудные волны U. Сопутствующий прием β-адреноблокаторов снижает диагностическую значимость пробы. Среди нежелательных реакций, возникающих на фоне инфузии адреналина, необходимо упомянуть артериальную гипертензию и индукцию опасных для жизни нарушений ритма. Диагностическое исследование должно быть прекращено при повышении систолического АД >200 мм рт.ст. (или при меньших значениях в случаях, если артериальная гипертензия сопровождается выраженными клиническими проявлениями), возникновении рецидивирующих неустойчивых пробежек или индукции устойчивого пароксизма ЖТ. В случае возникновения клинически значимых нежелательных эффектов целесообразно применение короткодействующих β-адреноблокааторов, вводимых внутривенно.
- Проба с аденозином. Больным СУИQT характерно увеличение продолжительности интервалов QT >410 мс и QTc >490 мс, регистрируемые во время минимальной частоты сердечных сокращений при индуцированной аденозином брадикардии. В настоящее время диагностическая значимость данной пробы изучена на ограниченном количестве больных генетически подтвержденным СУИQT, поэтому интерпретация полученных в ходе исследования результатов требует осторожности.
Дифференциальная диагностика
СУИQT следует дифференцировать от других возможных причин синкопальных, предсинкопальных и судорожных (!) состояний, учитывая относительно молодой возраст больных, прежде всего, от эпилепсии и вазовагальных обмороков, а также от других врождённых желудочковых нарушений ритма сердца.
Необходимо проведение дифференциальной диагностики между врождённой и приобретёнными формами СУИQT, которые могут быть вызваны целым рядом факторов, приводящих к замедлению процессов реполяризации миокарда желудочков. К ним относятся:
- брадикардия, обусловленная дисфункцией синусового узла или АВ блокадой;
- гипотиреоз;
- нарушения электролитного обмена (гипокалемия, гипомагнемия) вследствие применения диуретиков или патологии надпочечников (синдром Конна), а также профузной диареи или неукротимой рвоты;
- нарушения белкового питания (длительное «диетическое» голодание, нервная анорексия, парентеральное питание и др.);
- острый инфаркт миокарда;
- внутричерепное кровоизлияние
- интоксикация фосфорорганическими соединениями;
- приём лекарственных препаратов (перечень препаратов, удлиняющих интервал QT).
Уровень смертности при обмороках сердечного происхождения достигает 10 %.

50-летнюю Нину Михайловну «скорая» привезла в больницу с диагнозом судороги. Она проснулась среди ночи с сильной болью в животе. На глазах у мужа стала пепельно-серой, буквально обливалась потом… И тут вдруг потеряла сознание. Перестала дышать. Только через пару минут постепенно стала приходить в себя. Муж Нины Михайловны рассказал врачам, что судорог и прикусов языка во время и после приступа у жены не было, как не было и послеобморочной спутанности сознания. Сказал еще, что несколько лет назад, когда у нее свело икроножную мышцу, она точно так же теряла сознание.
После обследования пациенте поставили диагноз: сосудистый обморок, спровоцированный болью.
Второй случай. Пенсионер Даниил Ильич в последние месяцы падал в обморок даже несколько раз. Все начиналось со звона в ушах, и потом он на секунды отключался. Тут надо сказать и о прошлом «опыте» мужчины: два инфаркта, один инсульт.
После последнего обморока больного госпитализировали. У него был очень редкий пульс. Пациента уложили на койку, а вскоре он пробормотал медсестре: «Я ухожу…» На ЭКГ-мониторе в тот момент была долгая пауза — отсутствие сокращений сердца… Сейчас Даниил Ильич живет с водителем ритма — электрокардиостимулятором, который обеспечивает ему пульс нужной частоты.
Людей с обмороками не так и мало. И часто врачи в замешательстве: необъяснимые потери сознания. Могут, например, списать на трудноизлечимую эпилепсию. Тогда, увы, больные лечатся с неверным диагнозом. Очень часто таким диагнозом страдают дети.
У 12-летнего Никиты с пяти лет частые обмороки. Все это время он наблюдался у неврологов как эпилептик. Получал противосудорожные препараты, все большими и большими дозами. Без эффекта. При плановом медосмотре электрокардиограмма ребенка привлекла внимание аритмологов. Оказалось, эпилепсия тут ни при чем. Причина — в электрической аномалии в сердце. А проявляется она так: сердце иногда полностью останавливается, обычно после «залпов» быстрого, до 200 ударов в минуту, пульса. Теперь Никите помогает имплантированный кардиовертер-дефибриллятор. Прибор распознает опасные аритмии и тут же прерывает их, не давая сердцу «захлебнуться» в патологическом ритме.
Итак, обморок. Все знают, что это такое, но не все знают, почему так происходит. Потому что мозг вдруг не получает достаточно крови и кислорода. Почти у 50 % взрослых хотя бы раз в жизни случался обморок (кстати, его медицинский термин — синкоп). Вообще, из всех пациентов, обращающихся за неотложной помощью, больше 3 % — те, кто страдает синкопальными состояниями. Конечно, случаются обмороки и у почти здоровых людей. Провоцируются они, например, сильным испугом, болью, духотой, переутомлением, нагрузками. Но есть и куда более серьезные «провокаторы». В 10 % случаев за обмороками скрываются болезни сердца: кардиомиопатия, миокардит, врожденный порок сердца, а еще так называемые первичные электрические болезни сердца, при которых без явных признаков поражения сердечной мышцы может развиться жизнеугрожающая аритмия, говорит хирург, аритмолог, кардиолог 9-й клинической больницы Минска Сергей Моисеенко (на снимке).
Уровень смертности при обмороках сердечного происхождения достигает 10 % (более половины их связано с аритмией). В случае невыясненных причин синкопальных состояний смертность — 36,6 %.
Пациенты после обморока госпитализируются с самыми разными диагнозами. Определить истинные причины случившегося, утверждают доктора, порой непросто даже после тщательнейшего обследования. И в 25 % случаев эти причины остаются, увы, так и невыясненными, а пациент продолжает при этом сильно рисковать. Рискует, например, развить жизнеугрожающую аритмию, что может закончиться синдромом внезапной смерти. Или получить рецидивы пусть и менее фатальных, но тоже опасных обмороков. Наконец, при потере сознания можно попросту травмироваться. Упал, очнулся — разбитая голова. Или же представьте: человек «нырнул» в обморок прямо на рабочем месте, а работа его связана с высотой или движущимися механизмами...
Как видно, обмороки — проблема серьезная. А раз есть проблема — должно быть и решение, то есть своевременная диагностика и выбор правильной терапии этого опасного явления.
— Создать центр обморочных состояний — эту идею я вынашиваю несколько лет. В России, например, подобное учреждение работает уже давно, — рассказывает Сергей Моисеенко. — Есть идеи организовать такой центр на базе 9-й больницы или Минского консультационно-диагностического центра. Планируется привлечь специалистов, диагностические службы и оборудование из разных клиник. Пока в стране нет отдельных специалистов, занимающихся именно обмороками, а в кадровом реестре нет и такой специальности, как синкополог.
Даже после полного осмотра пациенту центра, если понадобится, назначат дополнительные исследования. То есть врачи будут делать все, чтобы определить-таки истинную причину болезни. А в случаях, когда в короткие сроки это сделать все же не удастся, пациента внесут в специальную базу данных, он будет регулярно наблюдаться специалистами до тех пор, пока не определят природу его синкопальных эпизодов. Ни один не уйдет после обследования, не получив ответов на свои вопросы, подчеркивает Сергей Моисеенко.
Сейчас создается виртуальный прототип центра. Он соберет внушительную библиотеку материалов, посвященных проблеме обмороков. Люди смогут бесплатно проконсультироваться онлайн, расшифровать ЭКГ и получить разную информацию о своем сердечно-сосудистом здоровье.

