Аритмогенная кардиомиопатия (АКМП). Лечение

Принцип лечения АКМП очень прост. Поскольку сердечная недостаточность обусловлена избыточной тахисистолией, необходимо или полностью устранить аритмию, либо (если полное устранение невозможно) добиться нормосистолии, что и приведет к редукции признаков ХСН.
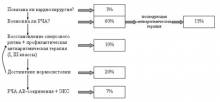
В лечении взрослого типа АКМП необходимо соблюдать следующую последовательность и ответить на следующие вопросы (см. схему):
- показано ли пациенту кардиохирургическое вмешательство по поводу его сердечной патологии (коррекция приобретенного или врожденного порока, АКШ-МКШ+ аневризмэктомия)? Если да, то необходимо это сделать с одномоментным выполнением операции MAZE-III. Если нет, переходим к следующему вопросу.
- показана ли пациенту катетерная аблация, устраняющая тахиаритмию?
- Если нет, то возможно ли восстановление синусового ритма?
- Если нет, то добиться стойкой нормосистолии приемом препаратов, действующих на АВ-соединение.
- Если нормосистолия не достигается или достигается приемом высоких доз препаратов (более 1 таб дигоксина+100 мг атенолола в сутки), то показана аблация АВ-соединения и имплантация частотоадаптивного ЭКС как метод последнего выбора.
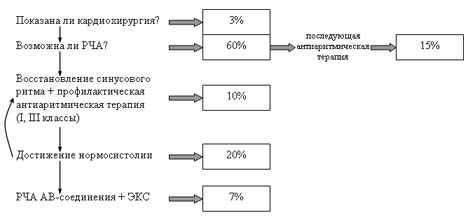
Не нужно забывать, что АКМП – это только синдром и ФП может возникать у пациентов с грубой органической патологией. Но таких больных немного (так как у большинства из них присутствует все же дилатационный тип ФП), и им показано кардиохирургическое вмешательство. Большинству пациентов (60%) показано выполнение катетерной аблации, которая т.о. является лидирующей лечебной процедурой при АКМП.
Это все формы трепетания предсердий, все хронические СВТ и идиопатическая форма фибрилляции предсердий. Причем (в последнем случае) у некоторых пациентов (каждый четвертый) электрическое ремоделирование заходит настолько далеко, что РЧ изоляция устьев легочных вен приводит к восстановлению синусового ритма, но у них могут сохраняться пароксизмы ФП, что требует назначения профилактической антиаритмической терапии.
Принцип достижения нормосистолии используется у больных глубокого старческого возраста, у больных с ИБС или пороками сердца на время до кардиохирургического вмешательства или при многолетнем существовании хронической тахисистолии. Если нормосистолия не достигается или достигается приемом высоких доз препаратов, необходимо еще раз рассмотреть вопрос об ЭДС с последующей антиаритмической терапией.
И лишь при отрицательном решении показано проведение РЧА АВ-соединения. Эта процедура является паллиативной, то есть приводит лишь к достижению искусственно нормосистолии, сохраняя ФП на предсердиях. Требуется лишь примерно 7% больным. В то же время, эта операция приводит к регрессу ХСН, но взамен «оставляет» пациенту новые жалобы и зависимость от электрокардиостимулятора.
Итак, 70% взрослых пациентов с АКМП нуждаются в том или ином хирургическом лечении. Причем у 48% больных (3% +45% после аблации) имеется шанс излечиться от аритмии, 45% больных (15% + 10% + 20%) будет принимать антиаритмические препараты, 27% больных (20% + 7%) будут принимать антикоагулянты.
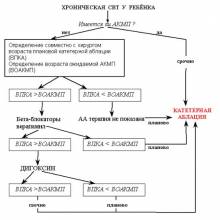
Лечение АКМП у детей имеет существенные отличия от взрослых пациентов, что обусловлено следующим:
1. Подавляющее большинство АКМП у детей – это последствия т.н. идиопатических аритмий, т.е. «аритмий здорового сердца».
2. Все три причины АКМП (трепетание предсердий, синдром WPW, автоматическая СВТ) – полностью устраняются катетерной аблацией. Это и определяет тактику лечения — всем детям с АКМП абсолютно показана катетерная аблация субстрата аритмии, которая приведет к ее устранению, регрессу ХСН и возвращению в общество здоровых и полноценных людей.
Дальше – речь пойдет о принципах терапии хронических СВТ у детей, поскольку лучшее лечение АКМП у детей – это ее профилактика. Хроническая СВТ может давать два осложнения, которые обязательно необходимо учитывать:
1) риск аритмогенной кардиомиопатии, скорость развития которой определяется ЧСС.
2) риск трансформации хронической СВТ в хроническую фибрилляцию предсердий.
Устраняя при помощи катетерной аблации СВТ, мы таким образом предотвращаем оба осложнения. Остается лишь единственный вопрос: когда делать аблацию и как вести этих детей до операции? Но этот вопрос и является самым важным, над которым бьются все специалисты по детской аритмологии. Именно ему мы и посвятим дальнейшее обсуждение.
Дело в том, что катетерная аблация у маленьких детей сопряжена с рядом трудностей:
1) отсутствие необходимого расходного материала для таких маленьких пациентов. Т.е. развитие техники для аритмологии существенно отстает от клинических возможностей. В частности самые тонкие диагностические и аблационные электроды имеют толщину 5 Фр.
2) малые размеры сердца и сосудов, что создает трудности для катетерных манипуляций и может приводить к осложнениям: перфорации стенок сердца и коронарного синуса, гемоперикард и тампонада; механическая фибрилляция желудочков.
3) размер радиочастотного повреждения при аблации является существенным относительно такого маленького сердца.
4) соединительнотканный рубец, формирующийся впоследствии на месте радиочастотного повреждения затрудняет рост миокарда в этой области и ведет к деформации камеры сердца, что в дальнейшем потенцирует появление других аритмий. Главным образом – предсердной экстрасистолии.
5) отсутствие четких знаний о нормальной электрофизиологии у детей раннего возраста.
Немаловажный аспект – проверка эффективности операции. У взрослого эффект аблации оценивается в послеоперационном периоде путем чреспищеводного ЭФИ. У ребенка ЧП-ЭФИ можно провести лишь в возрасте старше 8 лет, а у младших детей приходится проводить еще одну операцию – диагностическую — контрольное внутрисердечное ЭФИ.
Эти причины способствуют тому, что катетерные аблации у маленьких детей имеют риск осложнений примерно в 2-3 раза больше, чем у взрослых, и риск рецидива аритмии вследствие неэффективности воздействия в 3-4 раза больше, чем у взрослых. Причем чем младше ребенок, тем выше риск осложнений и неэффективности операции. В идеале каждому хирургу хотелось бы оперировать уже подростка, в возрасте старше 15 лет операция проходит также как и у взрослого. Но длительный аритмический стаж, нежелательная многолетняя медикаментозная терапия требуют установки более ранних сроков. Наш опыт позволяет определить минимальный возраст ребенка, когда риск осложнений и эффективность операции полностью соответствует взрослым: синдром WPW – 5 лет, АВ-узловая тахикардия – 7 лет, предсердная и желудочковая эктопия – 7 лет, трепетание предсердий – 9-10 лет. Различие в рекомендуемом для аблации возрасте обусловлено объемом вмешательства: точечное воздействие (при синдроме WPW), «кучное» воздействие (при аблации эктопического фокуса и АВУРТ), продолжительная линия из серии аппликаций – при трепетании предсердий. Конечно, эти сроки приемлемы для тех кардиоцентров, которые имеют достаточный опыт, то есть выполняют более 100 катетерных аблаций у детей в год.

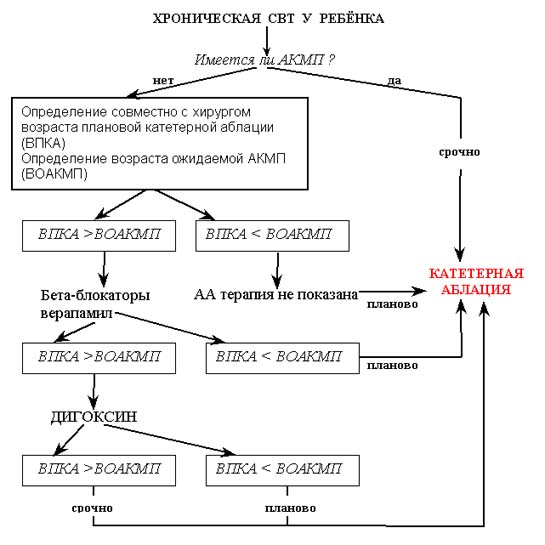
Итак, если ребенок достиг рекомендуемого для аблации возраста, она должна быть проведена.
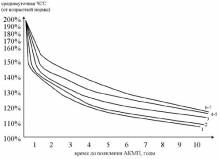
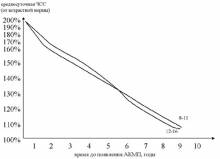
Если ребенок еще не достиг рекомендуемого для аблации возраста встает вопрос о медикаментозной терапии, цель которой – профилактика осложнений. Трансформация в фибрилляцию предсердий у детей возникает очень поздно: не ранее чем через 8-10 лет от начала хронической СВТ. Поэтому единственная задача медикаментозной терапии – профилактика развития АКМП. Для этого нам необходимо точно знать: когда появится АКМП у данного пациента при спонтанном течении его аритмии. Ниже я представляю формулы, позволяющие ориентировочно рассчитать время, в течение которого может развиться АКМП. Поскольку и при автоматической СВТ, и при «медленном» пучке Кента интервал PR меньше интервала RP’, то скорость развития АКМП определяется исключительно средней ЧСС в течение суток (кто это забыл, отправляю в главу о факторах, определяющих скорость развития АКМП).
Ниже мы рассмотрим алгоритм, позволяющий прогнозировать развитие АКМП.
- необходимо записать ХМ-ЭКГ «на чистом фоне» и вычислить среднесуточную ЧСС.
- выразить среднесуточную ЧСС в % от среднедневной возрастной ЧСС (популяционная норма), которая принимается за 100%
- на диаграмме по кривой соответствующего возраста находим вычисленное % значение и откладываем перпендикуляр на ось времени. Т.о. находим расчетное ожидаемое время до возникновения аритмогенной дилатации желудочков.
- прибавляем к настоящему возрасту ребенка время до наступления АКМП и получаем возраст ожидаемого возникновения АКМП.
Среднедневная ЧСС

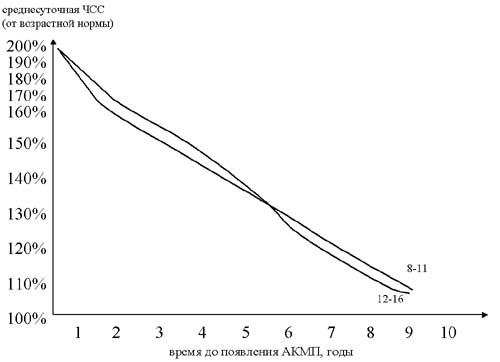
Вы можете видеть следующие тенденции:
-
скорость формирования АКМП замедляется от периода новорожденности до 6-7 лет и затем вновь возрастает. Таки образом в группе риска по быстрому развитию АКМП находятся дети с манифестацией хронической СВТ в возрасте до 1 года и старше 10 лет. Например, при возникновении хронической тахикардии со средней ЧСС – 140% у ребенка 1 года время трансформации в АКМП составит +1,7 лет; у ребенка 4 лет + 2,3 года; у ребенка 7 лет +4 года; в 12 лет + 5,3 года.
-
при возникновении частой СВТ (160% и выше) АКМП формируется у большинства в течение 1-1,5 лет.
Итак, если ожидаемое время формирования АКМП значительно позднее срока рекомендуемой аблации, — антиаритмическую терапию не назначаем и проводим лишь курсы кардиометаболической терапии (в основном, препараты калия, 3-4 раза вгод). Если к моменту рекомендуемой аблации вероятно наступление АКМП, — необходимо назначение антиаритмических препаратов, контролирующих ЧСС во время тахикардии. Таким образом, эти препараты снизят среднюю ЧСС тахикардии и, надолго отодвинут срок наступления АКМП, позволят провести катетерную аблацию еще без сердечной недостаточности. Поэтому, критерием эффективности этих препаратов будет расчетный возраст формирования АКМП, превышающий на 2 года и более возраст рекомендуемой аблации.
ВНИМАНИЕ!!!
Еще раз подчеркиваю, что цель терапии – не устранение аритмии, а лишь косметическое смягчение ее агрессивности (снижение ЧСС), которое отодвинет срок формирования АКМП.
Препаратами выбора являются антиаритмики, действующие на АВ-узел, а значит усиливающие фильтрацию предсердных сокращений.
1 ступень: бета-блокаторы или верапамил.
2 ступень: дигоксин.
Препараты первой ступени имеют наименьшее количество побочных эффектов. Но у маленьких детей первых лет жизни большим минусом является риск гипотонии, который может быть более существенным, чем у взрослых в силу еще незрелых механизмов регуляции АД, и что приводит к последующей отмене этих препаратов у 15% (по нашим данным). Выбор: бета-блокаторы или верапамил не принципиален и зависит от пристрастия и опыта врача. Преимущества бета-блокаторов в возможности двухкратного назначения (а не 3-4-кратного при верапамиле), что делает лечение более удобным. В то же время верапамил прекрасно подавляет фокусы предсердного автоматизма, что может принести дополнительную пользу при автоматической СВТ. В любом случае, если не получено эффекта от одного из этих препаратов, необходимо назначить другой.
Если не помогают представители обоих классов, то вопрос о переводе на дигоксин требует тщательного взвешивания. Этот препарат сильнее угнетает АВ-проведение, чем предыдущие, но он и несравнимо токсичнее. Помимо этого, у детей подросткового возраста при большом стаже хронической СВТ, он может трансформировать ее в фибрилляцию предсердий. Итак, при необходимости длительного многолетнего приема дигоксина, необходимо связаться с хирургом-аритмологом и выяснить: не следует ли в интересах ребенка (перед началом «токсичной антиаритмической терапии») провести катетерную аблацию «досрочно» (раньше запланированного возраста).
Также необходимо решать вопрос о сокращении «срока ожидания операции» в следующих случаях:
-
Недостаточная эффективность указанных выше препаратов
-
Возникновение побочных эффектов при антиаритмической терапии
-
Необходимость приема препаратов в дозе выше средней
Если антиаритмическая терапия неэффективна при наличии СВТ с высокой частотой (более 160% от среднесуточной), необходима катетерная аблация независимо от возраста ребенка (даже у детей раннего возраста).
Несколько важных моментов:
-
Никогда не назначайте комбинации антиаритмических препаратов
-
Никогда не назначайте в таких ситуациях кордарон – он крайне слабо воздействует на АВ-узел и будет оказывать лишь мощное внесердечное токсическое действие.
-
Перед любым «усилением» терапии посоветуйтесь с хирургом-аритмологом о необходимости более ранней операции.
Итак, единственным методом лечения хронических СВТ у детей является катетерная аблация. Она проводится без лишних раздумий, если уже имеются признаки АКМП; и планово в наиболее безопасном для операции возрасте – если признаков АКМП еще нет. Вопрос о медикаментозной антиаритмической терапии до операции решается на основании ЧСС тахикардии. Таким образом, период ожидания операции – это период взвешивания риска и балансировки между риском операции и неблагоприятными эффектами медикаментозной антиаритмической терапии. Чем в более раннем сроке проводится аблация, тем выше риск осложнений. Чем дольше продолжается антиаритмическая терапия, тем выше риск необратимых побочных эффектов и осложнений. Поэтому, при нарушении обычной схемы лечения, когда приходится увеличивать дозу препаратов, комбинировать с другими, при развитии побочных эффектов, чаша весов начинает склоняться в пользу хирургии, и срок ожиания операции должен уменьшаться.
В 1 больнице Минска врачи впервые провели операции по профилактике образования тромбов
В 1–й минской клинической больнице врачи впервые провели серию вмешательств по профилактике образования тромбов, которые опасны для жизни. Оторвавшись и попав в кровеносное русло, они могут закупорить сосуд, в том числе головного мозга. Особенность в том, что на этот раз не пришлось задействовать хирургов и применять общий наркоз. А пять пациентов, мужчины и женщины средних лет, быстрее пошли на поправку. Больничные палаты они покинули буквально на второй–третий день.
Речь о новой эндоваскулярной, внутрисосудистой методике — окклюзии ушка левого предсердия (в этом месте чаще всего и образуется тромб). Она становится буквально спасением при нарушениях ритма сердца — трепетании предсердий и мерцательной аритмии. Изначально таким пациентам врачи назначают лекарства, разжижающие кровь. «Однако у определенного процента людей эффект от их применения низкий или недостаточный. Для некоторых эти средства и вовсе небезопасны, так как могут спровоцировать не только аллергические реакции, но и кровотечения, — рассказывает заведующий ангиографическим кабинетом 1–й клиники, главный внештатный рентгенэндоваскулярный хирург комитета по здравоохранению Мингорисполкома Павел Черноглаз. — Потому выход был один — операция. Но если раньше, работая на опережение, хирурги проводили либо сложное вмешательство со вскрытием грудной клетки, либо оперировали без скальпеля при помощи эндоскопа, то сегодня появилась альтернатива».
Смысл в том, что в верхней части бедра в области паха врач делает небольшой прокол, вводит в него медицинские инструменты и под контролем рентгена ведет их через бедренную, а после полую вену до самого левого предсердия. Сюда и доставляют так называемый зонтик, или окклюдер, который раскрывается и заполняет изнутри собой ушко. Готово — надежную «заглушку» поставили! Теперь у тромба нет шанса навредить. И на все про все — только 40 — 50 минут. Кстати, расходы по такому ювелирному вмешательству полностью берет на себя государство, хотя стоимость только спасительного зонтика — около 10 тысяч у.е.
Раньше столь высокотехнологичные вмешательства были исключительно прерогативой РНПЦ «Кардиология» и Республиканского клинического медицинского центра Управления делами Президента. Теперь по–новому спасать пациентов будут и городские больницы. В 1–й минской клинике прорывной технологией владеют уже четыре специалиста.
Справка «СБ»
Мерцательной аритмией, приводящей к инсульту, страдают около 200 тысяч жителей Беларуси.
Советская Белоруссия № 93 (24723). Среда, 20 мая 2015
Автор публикации: Алла МАРТИНКЕВИЧ

